Данная работа посвящена ликбезу почтенной публики относительно того, как ДОЛЖНО разрабатывать ЛЮБОЙ лекарственный препарат, включая вакцины. Вранья и лапши на оттопыренные у TV уши навешано столько, что я испытываю чувство острейшего Испанского стыда. Далее только факты, которые каждый волен толковать или оправдывать в соответствии со своим сформированным миропониманием. Я не намерен пытаться его изменить.

(Испанский стыд – чувство неловкости или стыда за других, например, когда герой фильма делает что-то глупое, а стыдно тебе)
Для рассмотрения вопроса по существу, о реальной стоимости проводимых доклинических испытаний, можно воспользоваться неоднократно подтверждёнными данными специализированной исследовательской организации, осуществляющей мониторинг таких работ на протяжении более 40 лет.
При этом следует понимать стоимость разработки инновационных препаратов, начиная от голой идеи и заканчивая зарегистрированным препаратом с полным пакетом документов, легализующих его производство. Поскольку речь идёт действительно об инновационных патентуемых разработках, обратимся к международным данным, обрабатываемых на протяжении ряда десятилетий специализированными исследовательскими институтами, а также к методикам оценки стоимости разработок R&D.
Journal of Health Economics
Том 47, Май 2016года , Страницы 20-33
Основные моменты:
• Расходы на исследования и разработки 106 новых лекарств были получены из опроса 10 биофармацевтических фирм.
• Затраты на кандидатов в лекарственные препараты не прошедшие испытаний, были отнесены на затраты одобренных соединений.
• Предварительная оплата из собственных средств разработчика за одобренный препарат составляет 1395 миллионов долларов США (при цене доллара США в 2013г.)
• До вычета налогов капитализация за одобренный препарат составляет 2558 млн. долл. США (2013 год).
• Было установлено, что общие капитализированные затраты увеличились с реальным годовым уровнем на 8,5%.
• С учетом расходов на НИОКР после одобрения препарата (IV этап клинических испытаний при наличии препарата на рынке), оценка увеличивается до 2870 млн. Долл. США (в 2013 году).
https://www.sciencedirect.com/...
Внедрение нескольких новых удивительно дорогостоящих лекарств, отпускаемых по рецепту, возродило дебаты о происхождении и оправдании этих цен. На пресс-конференции в Бостоне, прошедшей в ноябре 2014 года, Центр изучения лекарств в Тафтсе объявил, что он подсчитал, что стоимость для фармацевтических компаний составляет 2,6 млрд. Долл. США при разработке нового препарата – выросшая от $ 802 млн, оцененной Центром в 2003 году.
https://www.nejm.org/doi/full/...
Разработка новых препаратов: сколько это стоит на самом деле?
В ноябре 2014 года Центр по изучению разработок лекарств Тафтс (Tafts) опубликовал результаты исследования, в рамках которого была проведена оценка средней стоимости научно-исследовательских и опытно-конструкторских разработок (НИОКР) новых препаратов. Цифра, которую приводят исследователи, – 2,56 миллиарда долларов США.
The NEW ENGLAND JOURNAL of MEDICINE
http://itpcru.org/2014/12/26/r...
ОК. Наиболее упёртые не признают весомыми приведённые выше первоисточники. Тады приглашаю их на отечественные площадки, например:
Стоимость разработки инновационных лекарственных средств «Центр фармакоэкономических исследований»
https://club.cnews.ru/blogs/en...
Движемся по теме далее. ДО того, как получить разрешение на клиническое испытане любого кандидата в Лекарственный Препарат (далее ЛП), необходимо сделать все возможные исследования о потенциальных угрозах разрабатываемого препарата на разных видах зверей. Все грабли, на которые наступило человечество при создании новых ЛП, учтены в списке доклинических исследований. Иного пути признания кандидата в ЛП аттестованным и зарегистрированным ЛП быть не может (если конечно вместо принципов доказательной медицины не вступит в силу политические хотелки партии и правительства).
Доклиническое исследование
Доклиническое тестирование гарантирует, что разработанные препараты не имеют потенциального вредного воздействия и могут быть протестированы на людях. Во время доклинического тестирования разработчики проводят исследования, чтобы предоставить подробную информацию об уровнях токсичности и оптимальных дозировках. Доклинические исследования строго регулируется FDA. Средняя стоимость этого этапа составляет $ 122 млн за 1,5 года.
Возможно у читателя поднимется внутреннее противление указанным выше цифрам и срокам. Мол это у них, у буржуинов, живущих на загнивающем и.т.д и.т.п.
Однако, вы в большинстве своём смотрите новости по TV. И после каждой новостной программы идёт просьба помочь деньгами на лечение ребёнка с помощью Лекарственного Препарата, который производится только там. Вы не задумывались о цене курса для ОДНОГО пациента в виде нескольких ампул препарата или даже одной? А стоило бы…
Пару недель назад я видел просьбу помочь ребёнку от смертельного нейродегенеративного заболевания стоимостью 150 000 000 рублей. И увы, это не предел.
Novartis' Zolgensma, a one-time gene therapy for spinal muscular atrophy tops the list with a price tag of $2.125 million. The cost of the treatment seems exorbitant at first glance.
(Новартис" Золгенсма", одноразовая генная терапия спинальной мышечной атрофии, возглавляет список с ценой в 2,125 миллиона долларов. Стоимость лечения на первый взгляд кажется непомерной.)
Top 10 Most Expensive Drugs on the Market.
Drug Annual cost based on length of therapy
Luxturna $850,000
Folotyn $793,870
Brineura $730,340
Blincynto $712,672
Ещё 6 строк•9 мар. 2021 г.
Top 10 Most Expensive Drugs on the Market | BioSpacehttps://www.biospace.com › article › gene-therapy-zolgen...
(Запрос в GOOGLE – «the most expensive course of treatment in the world»)
Попытки перенести на отечественную почву фармацевтической промышленности новейшие разработки 21 века имеют место быть, но в мизерном количестве и по срокам и цене являющимися реальностью экономики. Например:
На июль 2019 года в РФ не было ни одного лекарственного препарата по свойству и составу похожих на разрабатываемые препараты ХХХХХфармы. Наиболее близким по платформе является препарат созданный и зарегистрированный на основе антител (не РПАН). Биотехнологическая компания BIOCAD зарегистрировала первый отечественный оригинальный препарат на основе моноклональных антител - ингибитор интерлейкина-17 (anti-IL-17) для лечения среднетяжелого и тяжелого псориаза. На разработку и клинические исследования нового препарата Эфлейра® (международное непатентованное наименование – нетакимаб) потребовалось 7 лет.
https://biocad.ru/post/biocad_...
А теперь переходим к промышленным технологиям, законодательству РФ и международному законодательству, регулирующему работу с технологиями двойного назначения в биотехе.
На время начала работы над проектом по реконструкции или созданию нового производства вакцины с использованием генномодифицированного вируса и к моменту заключения контрактов на поставку биореакторов ОБЯЗАТЕЛЬНО выполнение основногое условия, определяющее уровень биобезопасности, соответствие требованиям технологического изолирования от окружающей среды. Вопросы безопасности создаваемых генно-инженерных конструкций должны решать комиссии по безопасности работы с рекомбинантными ДНК организаций, которые с ними работают, на основе национальных правил работы с рекомбинантными ДНК. Отсутствие такого документа закрывает все официальные возможности подачи заявки на приобретение оборудования двойного назначения. Здесь приводится ссылка к источнику, представляющему отечественный компетентный орган - Федеральное Государственное Бюджетное Учреждение "Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра "Курчатовский институт".
http://www.genetika.ru/vkpm/bi...
Ниже приведены ссылки на международные и европейские законодательные акты иллюстрирующие изложенные выше аргументы.
ООН (Security Council Distr.: General 18 April 2012 S/2012/236 ) запрещает распространение следующих технологий (Dual-use biological equipment and related technology and software- Биологическое оборудование двойного назначения и связанные с ним технологии и программное обеспечение ) (Fermenters capable of cultivation of pathogenic micro-organisms, viruses or for toxin production, without the propagation of aerosols, having a capacity of 20 litres or greater. Fermenters include bioreactors, chemostats and continuous-flow systems. - Ферментеры, способные культивировать патогенные микроорганизмы, вирусы или производить токсины без распространения аэрозолей, емкостью 20 литров или более. Ферментеры включают биореакторы, хемостаты и системы непрерывного потока.) стр. 14
https://documents-dds-ny.un.org/doc/UNDOC/GEN/N12/299/57/PDF/N1229957.pdf?OpenElement
В регуляторных требованиях комиссии ЕС по экспортному контролю список предметов двойного назначения согласован с указанным выше законом и основан на списке Австралийской группы. Объекты с полной защитой, соответствующие критериям безопасности уровня P3 или P4 (BL3, BL4, L3, L4), как указано в руководстве по биобезопасности лабораторий ВОЗ (The WHO Laboratory Biosafety Manual) (издание 3-e, Женева, 2004) должны подпадать под экспортный контроль.
http://www.australiagroup.net/...
Таким образом, как международное, так и европейское законодательство весьма жестко регламентирует поставки оборудования в области биотехнологий, необходимых для реализации проекта ХХХХфарма. При этом, отказ в продаже по любой причине, которую решит или не решит официально выдвинуть производитель, полностью закрывает возможность реализации проекта.
Западные регуляторы не рассматривают разрешение на такую поставку менее 3 месяцев. Но сутевая нагрузка состоит в том, что сама биотехнология промышленного производства на каждом этапе должна отслеживаться на МОЛЕКУЛЯПНОМ уровне и иметь возможноость уничтожения всей партии препарата, как только будет отмечено малейшее отклонение, поскольку отклонение означает массовое производство нового живого с неизвестными свойствами. Это обязательно будет происходить по природе вещей, т.к именно вирус РНК подвержен наибольшим мутациям.
Ну-с теперь ИТОГО:
домашнее задание на тренировку формальной логики и серого вещества - 0,5 года на весь цикл разработки вакцины, считаете реальным? А создание производств, крупносерийного производства вакцины (с момента регистрации вакцины), удовлетворяющих всем требованиям по биобезопасности и биозащите для генномодифицированных ЛП возможно?
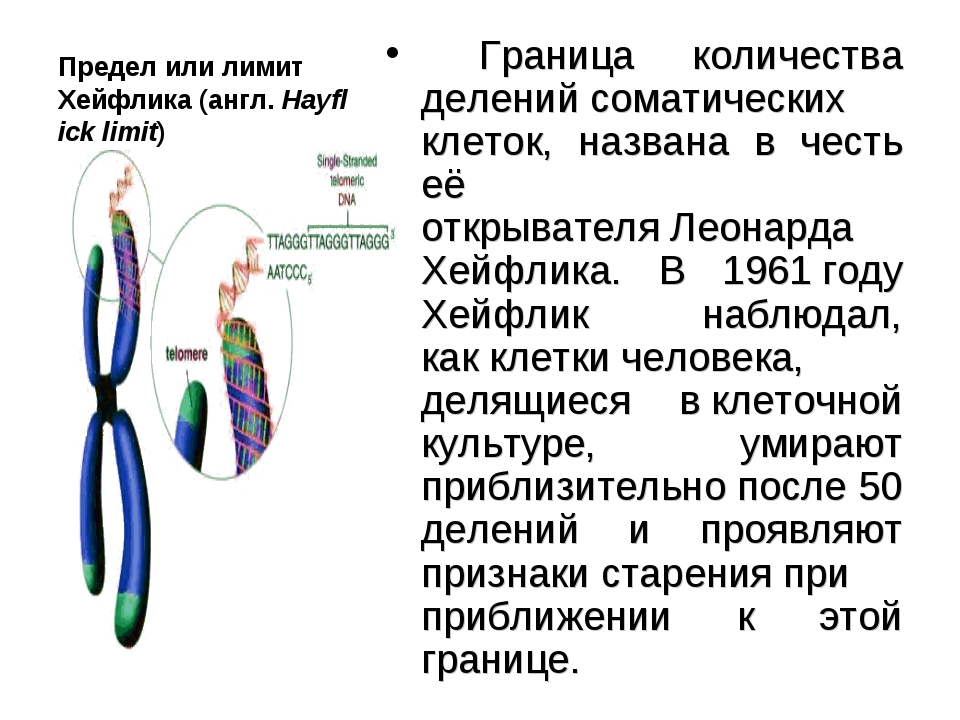
P.S. Статья получилась длинной, вопросы мелкого каннибальства, необходимого для производства вакцины, остались за скобками. Это связано с пределом Хейфлика.















Оценили 42 человека
70 кармы