Нет в сегодняшнем мире более интенсивно развевающейся области науки (в истинном и первичном понимании этого термина), как генетика.
Говоря более простым языком, человек вторгся в компетенцию Бога и способен на свой вкус и по своему, часто шкурному желанию, создавать новое живое, чего не могло БЫ быть никогда, если бы этим занималась природа и Всевышний. (Краткая иллюстрация к этому тезису в широко известном факте «скрещивания» обычного помидора и глубоководного окуня, которую вы можете купить прямо сейчас в соседнем супермаркете, даже не подозревая о самом факте)
И если любезный читатель полагает, что этот факт его не касается сейчас, или по крайней мере, не повлияет на остаток его жизни, то 1001 раз, увы, он ошибается…
Для тех, кто имеет отличное от описанного выше миропонимание о личной непричастности, сделан этот текст. Вам понадобится 12+7,5 минут, чтобы прочесть или посмотреть в оригинале на английском (с субтитрами на русском) два выступления генетика Дженнифер Доудна — одной из изобретателей прогрессивной новой технологии редактирования генов, названной CRISPR-Cas9, и лауреата Нобелевской премии. Это необходимо для того, что бы осознать, как суть самой технологии, подсмотренной у природы, так и возможные последствия её применения.
Между просмотрами или чтением текста, я позволю себе вставить свои 5 коп., объясняющими сутевую нагрузку заголовка этой статьи.
Итак:
Теперь мы умеем редактировать ДНК. Но давайте проявим благоразумие
Генетик Дженнифер Доудна — одна из изобретателей прогрессивной новой технологии редактирования генов, названной CRISPR-Cas9. Этот инструмент позволяет учёным вносить точные правки в нити ДНК, что может привести к возможности лечить генетические заболевания… но также может быть использовано для создания так называемых «дизайнерских детей». Доудна рассматривает, как работает система CRISPR-Cas9 — и просит научное сообщество сделать паузу и обсудить этические аспекты этого нового инструмента.
https://www.ted.com/talks/jenn...
Несколько лет назад мы с моей коллегой Эммануэль Шарпентье изобрели новую технологию редактирования геномов. Она называется CRISPR-Cas9. Технология CRISPR позволяет учёным вносить изменения в ДНК внутри клеток, что может дать нам возможность вылечивать генетические заболевания.

Возможно, вам будет интересно узнать, что технология CRISPR возникла в рамках проекта фундаментальных исследований, целью которого было выяснение того, как бактерии борются с вирусными инфекциями. Бактериям приходится сталкиваться с вирусами в среде своего обитания, и вирусную инфекцию можно представить как тикающую бомбу замедленного действия: у бактерии есть всего несколько минут, чтобы её обезвредить до того, как бактерия будет разрушена. В клетках многих бактерий существует адаптивная иммунная система — CRISPR, позволяющая им выявлять и разрушать вирусную ДНК.
В состав системы CRISPR входит белок Cas9, который способен искать, расщеплять и в конечном итоге уничтожать вирусную ДНК особым способом. И именно в ходе нашего исследования по изучению активности этого белка, Cas9, мы поняли, что можем использовать его активность в генно-инженерной технологии, которая позволит учёным удалять и вставлять фрагменты ДНК внутрь клеток с невероятной точностью, что позволило бы делать то, что ранее было просто невозможно.
Технология CRISPR уже используется для изменения ДНК в клетках мышей и обезьян, а также других организмов. Недавно китайские учёные показали, что им удалось использовать технологию CRISPR даже для изменения генов эмбрионов человека. Учёные из Филадельфии показали возможность применения CRISPR для удаления ДНК интегрировавшегося вируса ВИЧ из инфицированных клеток человека.
Возможность осуществлять редактирование генома таким образом также вызывает различные этические вопросы, которые следует иметь в виду, потому что технологию можно применять не только к клеткам взрослых, но также и к эмбрионам разных организмов, в том числе и нашего вида. Таким образом, вместе с коллегами мы начали международное обсуждение изобретённой нами технологии, чтобы иметь возможность учесть все этические и общественные проблемы, связанные с подобными технологиями.
А сейчас я хочу рассказать вам, что такое технология CRISPR, что она позволяет делать, на каком мы сейчас этапе и почему я считаю, что нам нужно с осторожностью продвигаться вперёд по пути применения этой технологии.
Когда вирусы инфицируют клетку, они впрыскивают свою ДНК. И внутри бактерии система CRISPR позволяет выдернуть эту ДНК из вируса и вставить её маленькие фрагменты в хромосому — в ДНК бактерии. И эти фрагменты вирусной ДНК вставляются в область, называемую CRISPR. CRISPR означает «короткие палиндромные повторы, регулярно расположенные группами». (Смех)

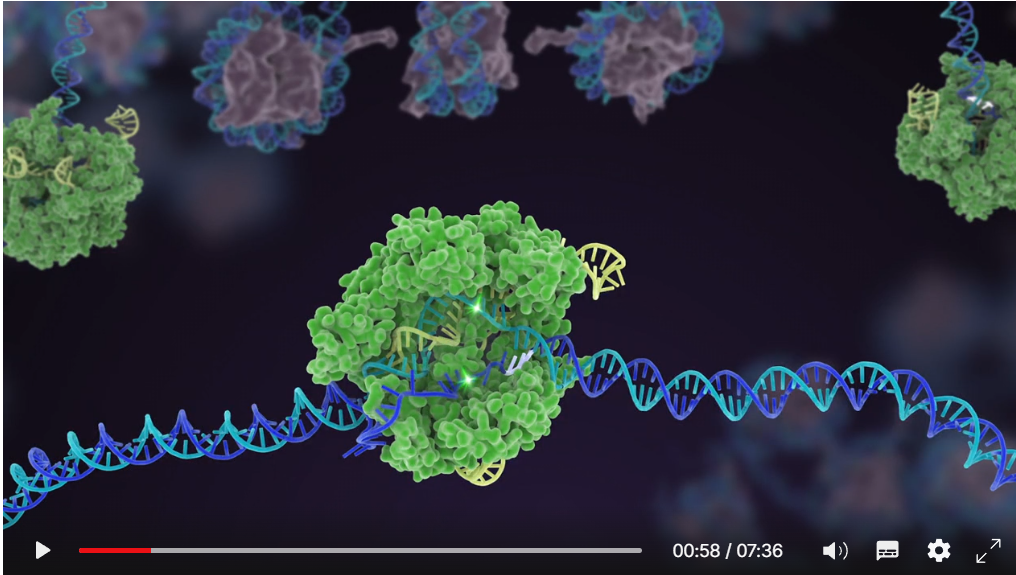
Глубоко взглотнув - вы можете понять, почему мы используем аббревиатуру CRISPR. Это механизм, который позволяет клеткам записывать данные с течением времени, вирусы, которым они подвергались. И что важно, эти фрагменты ДНК передаются потомству клеток, таким образом, клетки защищены от вирусов не только в одном поколении, но на протяжении многих поколений клеток. Это позволяет клеткам вести учет инфекции, и, как любит говорить мой коллега Блейк Виденхефт, локус CRISPR фактически является картой генетической вакцинации в клетках. Как только эти фрагменты ДНК будут вставлены в бактериальную хромосому, затем клетка создает маленькую копию молекулы, называемой РНК, что выделено оранжевым на этой картинке, это точная копия вирусной ДНК. РНК - химический родственник ДНК, и это позволяет взаимодействовать с молекулами ДНК у которых есть соответствующая последовательность.
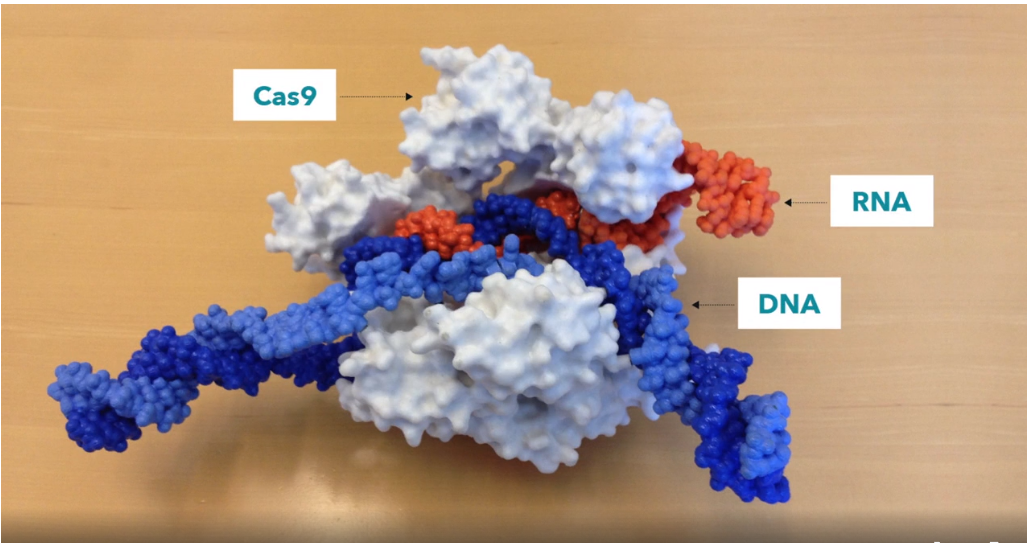
Итак, эти маленькие фрагменты РНК, образованные с локуса CRISPR, ассоциируют, связываются с белком под названием Cas9, на этом рисунке он белый, и образуется комплекс, который выполняет в клетке функции часового. Он просматривает всю ДНК в клетке, чтобы найти участки, соответствующие последовательностям связанных с ним РНК. И когда эти участки найдены, как можно видеть на рисунке, где ДНК — это синяя молекула, этот комплекс связывается с этой ДНК и даёт белку Cas9 разрезать вирусную ДНК. Он очень точно вносит разрыв. Мы можем рассматривать этого часового, комплекс белка Cas9 и РНК, как пару ножниц, которые могут разрезать ДНК, — он делает двуцепочечный разрыв в спирали ДНК. И важно, что этот комплекс можно запрограммировать, например, можно его запрограммировать узнавать нужные последовательности ДНК и разрезать ДНК на этом участке.
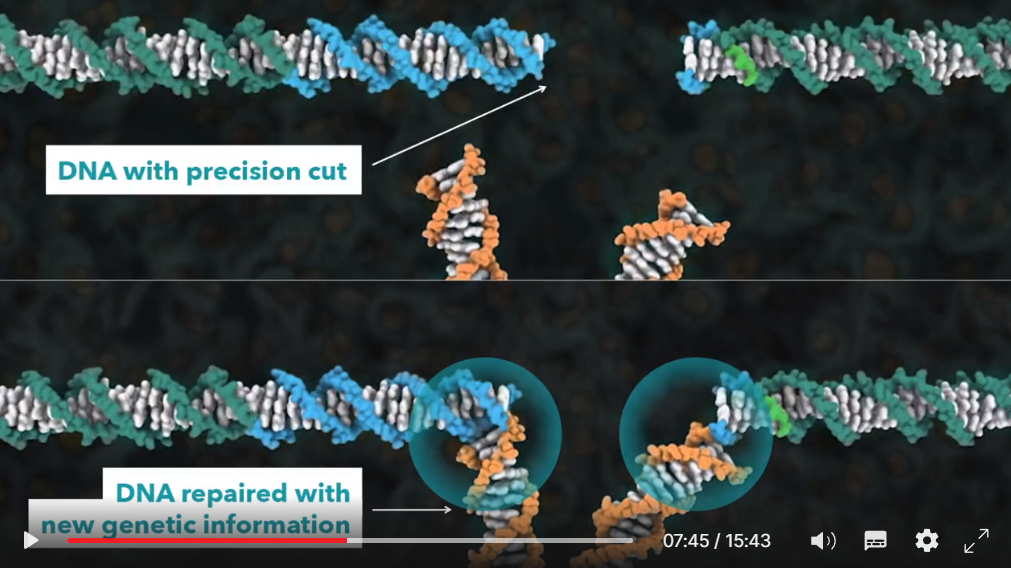
Как я собираюсь вам рассказать, мы поняли, что эту активность можно использовать в генной инженерии, чтобы позволить клеткам вносить очень точные изменения в ДНК на участке, где был сделан данный разрез. Это примерно, как использование программы, обрабатывающей слова, для исправления опечаток в документе.
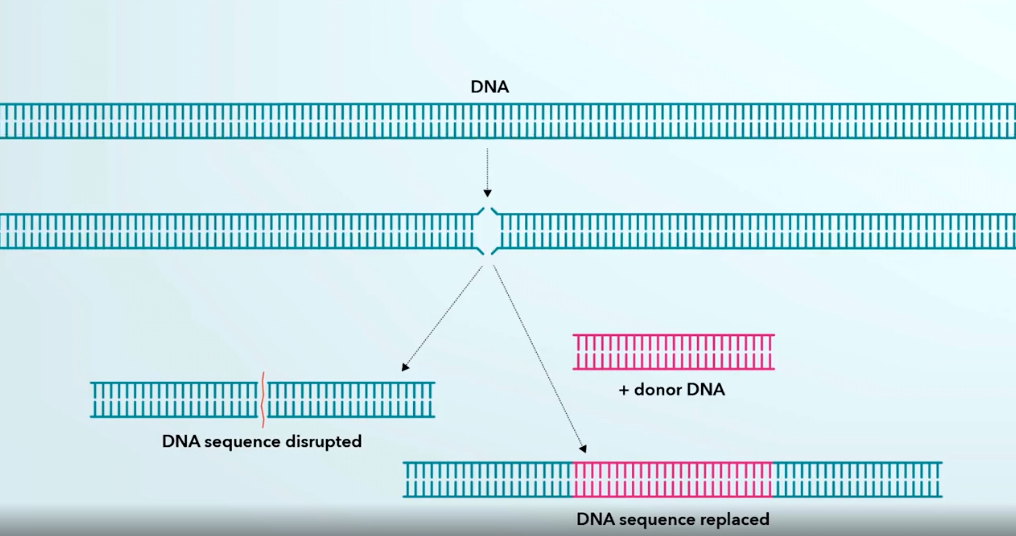
Мы смогли предположить, что систему CRISPR можно использовать в геномной инженерии, поскольку клетки способны находить разорванную ДНК и восстанавливать её. Итак, когда клетка растения или животного находит двуцепочечный разрыв в своей ДНК, она способна его устранить, либо соединяя разорванные концы ДНК, внося незначительное изменение в последовательность в этом месте, либо она может устранить разрыв, вставив новый участок ДНК в место разрыва. Таким образом, если мы можем вносить двуцепочечные разрывы в ДНК в строго определённых местах, мы можем заставить клетки восстанавливать эти разрывы, при этом либо разрушая генетическую информацию, либо внося новую. И если бы мы смогли запрограммировать технологию CRISPR таким образом, чтобы разрыв в ДНК вносился в положении мутации или рядом с мутацией, вызывающей, например, муковисцидоз, мы могли бы заставить клетки исправить эту мутацию.
Вообще-то, геномная инженерия — не новая область, она развивается с 1970-х годов. У нас есть технологии для секвенирования ДНК, для копирования ДНК, даже для манипуляций с ДНК. И это весьма многообещающие технологии, но проблема в том, что они были либо неэффективны, либо слишком сложны в использовании, поэтому большинство учёных не могли использовать их в своих лабораториях или применять в клинических условиях. Таким образом, существовала потребность в такой технологии как CRISPR, потому что она относительно проста в использовании. Старые технологии геномной инженерии можно представить себе как необходимость перемонтировать ваш компьютер каждый раз, когда вы хотите запустить новую программу, тогда как технология CRISPR — это что-то вроде программного обеспечения для генома: мы легко можем её программировать, используя маленькие фрагменты РНК.
Как только сделан двуцепочечный разрыв, мы можем вызвать процесс восстановления и тем самым, возможно, достичь поразительных результатов, например, исправлять мутации, вызывающие серповидноклеточную анемию или болезнь Хантингтона. Лично я считаю, что первые случаи применения технологии CRISPR будут связаны с кровью, где относительно просто доставлять этот инструмент внутрь клеток, по сравнению с плотными тканями.
Прямо сейчас во многих проводимых работах метод применяют в животных моделях болезней человека, например, на мышах. Технологию используют для внесения очень точных изменений, что позволяет нам изучать то, как эти изменения клеточной ДНК влияют либо на ткань, либо, как здесь, на целый организм.

В этом примере технологию CRISPR использовали для разрушения гена путём внесения небольшого изменения в ДНК в гене, который отвечает за чёрную окраску шерсти этих мышей. Представьте, эти белые мышата отличаются от своих окрашенных братьев и сестёр всего только небольшим изменением одного гена во всём геноме, а в остальном они абсолютно нормальны. И когда мы секвенируем ДНК этих животных, то обнаруживаем, что изменение в ДНК произошло именно в том месте, где мы планировали, используя технологию CRISPR.
Также проводятся эксперименты и на других животных, у которых удобно создавать модели болезней человека, например, на обезьянах. И в этом случае мы обнаруживаем, что эти системы можно использовать для тестирования применения данной технологии к определённым тканям, например, для выяснения того, как доставлять инструмент CRISPR в клетки. Мы также хотим расширить наше понимание того, как можно контролировать способ восстановления ДНК после её разрыва, и выяснить, как можно контролировать и ограничивать нецелевое воздействие, или непреднамеренные эффекты, при использовании этой технологии.
Я полагаю, что мы станем свидетелями использования данной технологии в клинике, разумеется, у взрослых пациентов, в течение следующих 10 лет. Мне кажется вероятным, что за этот период будут проведены клинические исследования и, возможно, даже одобрены методы терапии, что очень воодушевляет. И благодаря этому воодушевлению, которое вызывает технология, к ней проявляют огромный интерес стартап-компании, созданные для того, чтобы превратить технологию CRISPR в коммерческий продукт, а также многие венчурные капиталисты,
инвестирующие в такие компании. Но мы также должны учитывать, что технологию CRISPR можно использовать для улучшения характеристик. Представьте, что мы могли бы попробовать конструировать людей, обладающих улучшенными характеристиками, например, более прочными костями, или меньшей склонностью к сердечно-сосудистым заболеваниям, или даже обладающих свойствами, которые, возможно, показались бы нам желательными, такими как другой цвет глаз или более высокий рост, что-то вроде этого. Если хотите, это «дизайнерские люди». Сейчас практически отсутствует генетическая информация, позволяющая понять, какие гены отвечают за эти признаки. Но важно понимать, что технология CRISPR дала нам инструмент для внесения таких изменений, как только эти знания станут нам доступны.
Это поднимает ряд этических вопросов, которые мы должны тщательно рассмотреть. И именно поэтому мы с коллегами призвали учёных всего мира сделать паузу в любых клинических применениях технологии CRISPR у эмбрионов человека, чтобы у нас было время тщательно рассмотреть все возможные последствия этого. И у нас есть важный прецедент для того, чтобы объявить такую паузу: в 1970-х годах учёные объединились для провозглашения моратория на использование молекулярного клонирования,пока не будет тщательно проверена и подтверждена безопасность этой технологии.Так что пока генная инженерия людей откладывается, но это уже не научная фантастика. Созданные генной инженерией животные и растения уже существуют. И это накладывает на всех нас большую ответственность и необходимость учитывать как нежелательные последствия, так и роль преднамеренного влияния этого научного прорыва.

Со времени этой публичной лекции в сентябре 2015 года прошло не так много времени и новые прорывные исследования в области CRISPR технологии открывают и новые горизонты использования и… новые крайне серьёзные опасности её применения уже в планетарном масштабе.
Выступление Дженнифер Даудна, которое вы прочтете (или посмотрите по ссылке ниже), в том числе акцентирует внимание читателя и на модной проблеме выделения метана животными и человеком в процессе жизнедеятельности. Я понимаю эту часть выступления, как необходимую дань сегодняшней глобальной политике и следующей за ней политике предоставления гранта Audacious Project 2023.
Она объясняет, как её команда в Институте инновационной геномики создаёт новую область науки, точное редактирование микробиома, которая использует CRISPR в решении, казалось бы, непреодолимых проблем вроде астмы, болезни Альцгеймера и изменения климата.
Однако, я возвращаю читателя к мысли, что эта технология УЖЕ позволяет редактировать не только ДНК человека, но и неимоверно более сложный суперорганизм – микробиом человека, состоящий из триллиона различных микроорганизмов, в огромной степени контролирующий своего хозяина. Перекрёстное влияние различных микроорганизмов, живущих на и в человеке определяет не только его заболевания/здоровье, но и ментальную способность, выработку иммунной системой необходимой защиты от вторжения микроорганизмов.
(По теме: You are what you eat - Ты есть то, что ты ешь 3.0 )
Итак, вторая часть «Марлезонского балета»:
Следующий прогресс CRISPR значительнее, чем вы думаете

https://www.ted.com/talks/jenn...
Сущность человека заключается в том, что мы решаем проблемы. И когда мы сталкиваемся с огромными проблемами вроде болезни и изменения климата, мы должны решать их путём взаимодействия.
Мне не терпится рассказать вам о новом типе взаимодействия, которое обязательно найдёт решения этих важных проблем. Это взаимодействие неожиданное, потому что оно между людьми и мельчайшими организмами, населяющими нашу планету: бактериями и другими микробами, живущими в нас, на нас и вокруг нас.
Бактерии могут быть малы и невидимы глазу, но они часто стимулируют преобразующие инновации, включая ту, что стала краеугольным камнем моего собственного исследования. В течение последнего десятилетия я была на передовой линии развития революционной технологии под названием CRISPR, возникшей из изучения, как же бактерии борются с вирусной инфекцией. Технология CRISPR удивительна, потому что позволяет нам точно редактировать ДНК в живых организмах, включая людей и растения. С помощью CRISPR мы можем изменять, удалять или заменять гены, регулирующие функции клеток. Это значит, что мы можем использовать CRISPR теперь как текстовый редактор для поиска, вырезания и вставки текста.
Удивительно, CRISPR уже лечит людей от серьёзных болезней как, например, серповидноклеточная анемия, и помогает выводить сорта риса, устойчивые и к заболеваниям и к засухе. Невероятно, правда? Но следующее достижение с помощью CRISPR, которое изменит мир, будет связано с использованием этой технологии таким образом, что позволит нам перейти на следующий уровень путём редактирования генов выше отдельно взятых организмов. Теперь у нас есть возможность использовать CRISPR для редактирования целых популяций крошечных микробов, называемых микробиомами, которые живут внутри нас и на нас.
В течение десятилетий учёные изучали одни бактерии изолированно от других, как будто каждый тип бактерий ведёт себя независимо. Но сейчас мы знаем, что поведение бактерий, и полезных и вредных, является результатом их взаимодействия в сложных микробиомах. У людей нарушения микробиомов кишечника связаны с разными недугами, как болезнь Альцгеймера и бронхиальная астма. А у домашнего скота микробиомы производят метан, значительно влияющий на изменение климата. Но здоровые микробиомы и человека и животного могут предотвращать болезнь и сокращать выбросы метана. Чтоб использовать эти выгоды, нам нужен способ для точного и последовательного контроля этих микробных сообществ.

Почему же в прошлом микробиомы было трудно контролировать? Оказывается, что микробиомы очень сложные, и на них нелегко воздействовать. Антибиотики влияют на весь микробиом, и злоупотребление ими может вызвать сопротивление их действию. Диеты и пробиотики неспецифичны и часто неэффективны. Пересадка кала сопряжена с проблемами как эффективности, так и принятия.

Но с технологией CRISPR у нас есть инструмент, работающий как скальпель. Он позволяет нам найти конкретный ген в конкретном типе клеток. С помощью CRISPR мы можем изменить один тип бактерий, не затрагивая все остальные.
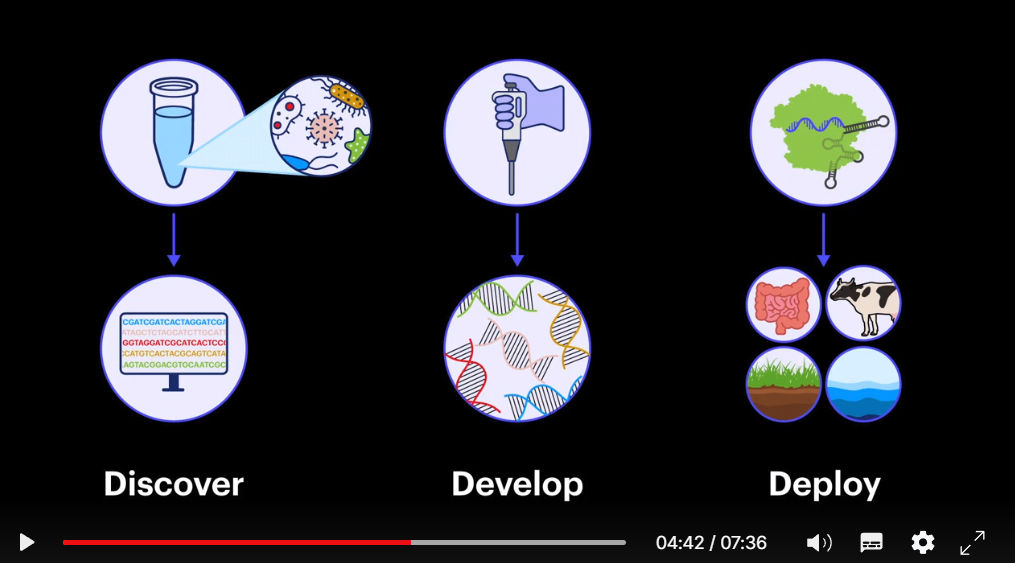
Другая сложность в том, что в мире менее одного процента видов микробов было культивировано и изучено в лабораториях. К счастью, теперь нам доступны оставшиеся 99 процентов благодаря новаторскому исследованию моей коллеги, Джилл Бэнфилд, и её прорывной технологии, метагеномики, которая позволяет нам выяснить, какие виды присутствуют и что они делают в микробном сообществе. Метагеномика создаёт подробную схему сложного микробиома, а это значит, что мы можем её использовать, чтобы понять, как использовать инструменты редактирования генов в нужном гене, в нужном организме.
Возможно, вас удивляет, как мы можем применить эти новые знания для решения реальных мировых проблем. Мы объединяем эти две прорывные технологии, метагеномику и CRISPR, чтобы создать новую область знаний: точное редактирование микробиома. Она позволит нам выявлять связи между нарушенными микробиомами и болезнями или выбросами парниковых газов. Мы можем создать улучшенные редакторы микробиома и показать, что они безопасны и эффективны. И тогда мы можем начать внедрять эти оптимизированные решения, чтобы создавать такие типы решений, которые станут преобразующими в будущем.
Так как это влияет на наше здоровье и здоровье нашей планеты? Известно, что изменение климата влияет больше всего на беднейшие страны и людей, и что эта проблема создана богатейшими людьми. И метан создаёт большую часть проблемы. Он был основным фактором роста глобальных температур, начиная с доиндустриальных времён. Специфический состав микробиома домашнего скота может реально сократить выбросы метана на 80 процентов. Но чтобы заниматься им сейчас, нужны ежедневные дорогостоящие вмешательства, и эти усилия не масштабируются.
Однако с точным редактированием микробиома мы можем изменять микробиом телёнка при рождении, ограничивая влияние этого телёнка на климат в течение всей его жизни. И это выгодно для фермеров, потому что сниженная выработка метана означает более эффективную конверсию корма в фермерскую продукцию. Важно, что эти инструменты могут использоваться в будущем для сокращения выбросов метана другими источниками, например, свалками, сточными водами и рисовыми полями. В конечном счёте микробиомы производят до двух третей глобального объёма выбросов метана. И наша технология могла бы заметно продвинуть борьбу с климатическими изменениями.
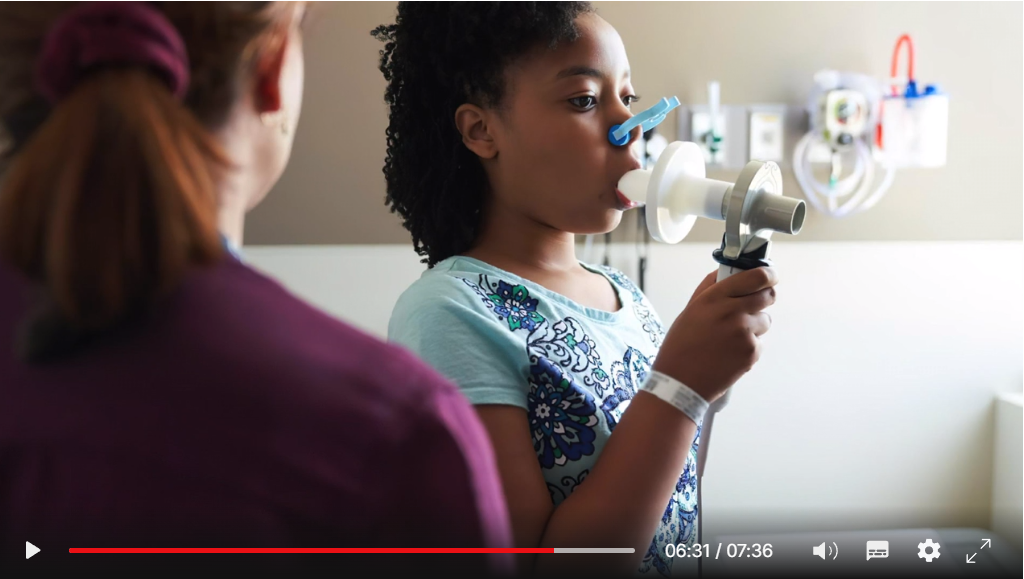
В сфере здоровья людей, астма поражает до 300 миллионов человек по всему миру, причём это число растёт на 50 процентов каждое десятилетие и гораздо чаще затрагивает детей в семьях с низкими доходами. Наша команда выявила уверенную связь между образованной в микробиоме кишечника молекулой и развитием астмы. С точным редактированием микробиома мы могли бы предложить ребёнку с риском астмы неинвазивную терапию, которая бы устранила вызывающие астму молекулы, меняя жизненный путь этого ребёнка. И действительно интересно, что те же подходы в будущем могут помочь нам лечить или даже предотвращать болезни человека, связанные с микробиомом кишечника, включая ожирение, диабет и болезнь Альцгеймера.
Мне кажется удивительным, что мы теперь можем использовать CRISPR для редактирования тех же мельчайших организмов, которые открыла нам CRISPR. При этом мы сотрудничаем с важнейшим партнёром, природой. Вместе мы можем, используя CRISPR, точно редактировать микробиом для того, чтобы построить более устойчивое будущее для всех нас.
ИТОГО: И здесь я возвращаюсь к исходному тезису этой работы, о том, почему очередное открытие в области микробиологии и генетики вполне может оказаться тем самым «черным шаром», который окончательно разрушит сложнейший и уравновешенный механизм микробиома и человека, как впрочем, оно имеет потенциальную возможность «разбудить» ретровирусы и в каждой клетке человека. Механизм этого открытия приведен ниже от имени исследователей.
Технология, которая может положить конец человечеству— и как это остановить https://cont.ws/@h5n1/2268327















Оценили 68 человек
154 кармы