Всем известно, что место поцелуя варьируется в широчайших пределах, а место клизмы изменить нельзя. Также как нельзя изменить мнение о себе человека с синдромом Денинга-Крюгера - уж если он решил, что компетентен в том, о чём по факту не имеет даже общего представления, никто его в обратном не переубедит.

Для остальных читателей предлагаю просмотреть очередную тему о вакцинах против страшного и ужасного SARS-COV-2.
Тема навеяна работой «Клинические испытания новой вакцины «Бетувакс-КоВ-2» стартовали в России»
Несомненно работа в направлении полного цикла разработки ЛЮБОГО лекарственного препарата, включая вакцины, заслуживает внимания и уважения. Но давайте обсудим базовые понятия, а так же природу предлагаемых нашему вниманию фактов.
Несомненно, проведённый комплекс ДОКЛИНИЧЕСКИХ испытаний кандидатов в лекарственные препараты это уже СЕРЬЁЗНЫЙ успех, относительно полного игнорирования этой фазы при регистрации пошедших в серийное многомиллионное производство других отечественных вакцин против SARS-COV-2.
Коротко о принципах комплекса испытания любого кандидата в лекарственные препараты здесь.
Рассмотрим исходный тезис, указанной по первой ссылке работы: «В России началась I/II фаза клинических испытаний субъединичной вакцины от коронавируса «Бетувакс-КоВ-2». В ходе исследования препарат будут вводить 170 людям два раза, с интервалом в месяц».
Когда десятки отчётов из научных институтов, изучавших на животных все известные науке побочные эффекты для кандидата в ЛС, собираются в единый итоговый файл, он тщательнейшим образом проверяется экспертизой документов, необходимых для разрешения на проведение клинического исследования лекарственного препарата в федеральном государственном учреждении «Научный центр экспертизы средств медицинского применения» Минздрава России, а так же экспертами независимой структуры, одобряющей допуск лекарств для испытания на людях - этическая экспертиза в Совете по этике при Минздраве России. При этом, последняя из указанных компетентных организаций, осуществляет не только тщательную проверку всех необходимых и достаточных экспериментов проведённых на животных, но и соответствие предлагаемого дизайна клинических исследований на людях, с точки зрения как отечественных, так международных регулирующих документов (Нюрнбергскому кодексу, Декларации WMA Хельсинки – Этические принципы для медицинских исследований с участием людей, Этические принципы и руководящие принципы защиты людей, как субъектов исследования, Доклад Бельмонта и др.). Этот же итоговый файл подаётся на рассмотрение экспертам в страховую компанию, которая принимает решение о страховании жизни и здоровья пациентов при клинических исследованиях кандидата в ЛС. Сами пациенты тщательно знакомятся с составом кандидата в ЛС, процедурой применения, контролем за их здоровьем в период КИ и время спустя. После чего они подписывают документ «Информированное согласие пациента». Очевидно, что дизайн КИ и объём информации доступный пациентам максимально возможно представлен в этом документе.
Далее наступает самый ответственный этап – клинические испытания кандидата в ЛС на людях.
Посмотрим и в профессиональный источник, поясняющий, что представляет собой I фаза Клинических Испытаний.
Прежде чем потенциальное ЛС можно будет дать людям, разработчики препарата обязаны провести полномасштабные исследования на животных. Основные цели таких доклинических исследований заключаются в следующем:
• выявление действия препарата на системы организма (фармакодинамика);
• определение содержания препарата в крови, механизмов всасывания, распределения, метаболизма и выведения после попадания в организм (фармакокинетика);
• оценка токсичности диапазона доз препарата для животных, во много раз превышающих планируемые для людей, и, в случае токсичности определение поражаемых органов и пределов безопасности, выраженных: а) в дозе, при которой не наблюдаются нежелательные эффекты (NOAEL), относительно массы тела и б) в воздействии препарата – концентрации препарата в кровотоке в течение 24 часов (токсикокинетика) [1];
• разработка оптимальной лекарственной формы препарата.
Только после тщательного изучения потенциального ЛС на животных и получения перспективных и безопасных результатов приступают к исследованиям I фазы. Большинство исследований I фазы проводится с участием здоровых добровольцев. Однако по этическим причинам и соображениям безопасности в некоторых исследованиях участвуют только пациенты с заболеванием, для которого разрабатывается препарат.
В успешных случаях исследования I–III фаз могут проводиться до 10 лет, однако многие продукты изымаются из разработки главным образом по следующим причинам:
• плохая переносимость или недостаточная безопасность препаратов для людей;
• неудовлетворительный фармакокинетический или фармакодинамический профиль;
• неэффективность или недостаточная эффективность для лечения целевого заболевания.
Десятилетний анализ исследований новых ЛС показал, что только в 60% случаев исследования I фазы переходили во II фазу и лишь 11% лекарственных средств попадали в продажу. Исследования I фазы позволяют выявить ЛС с потенциалом на успех, а также отсеять неэффективные препараты без вовлечения большой выборки пациентов.
В настоящее время основополагающими документами регулирования проведения клинических исследований, в т.ч. I фазы в РФ являются:
• Федеральный закон от 12 апреля 2010 г. №61-ФЗ «Об обращении лекарственных средств»;
• Национальный стандарт Российской Федерации ГОСТР 52379-2005 «Надлежащая клиническая практика»;
• Постановление Правительства РФ от 13 сентября 2010 г. №714 «Об утверждении типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата»;
• Приказ Минздравсоцразвития России от 31 августа 2010 №774н «О Совете по этике».
При планировании исследования I фазы учитывается происхождение лекарственного препарата, например:
• химические структурные элементы,
• биотехнологические препараты,
• препараты клеточной терапии,
• препараты генной терапии,
• препараты, полученные из плазмы,
• другие экстрактивные средства,
• препараты растительного происхождения;
• гомеопатические препараты,
• радиофармацевтические соединения.
Биотехнологические ЛС (также называемые биологические лекарственные препараты) – это рекомбинантные белки, гормоны, цитокины, моноклональные антитела, генетические модифицированные микроорганизмы (ГММ) и генетические лекарственные препараты. В настоящее время у нас нет различий в регулировании исследований биотехнологических лекарственных препаратов, в отличие от мировой практики, где рассмотрение экспериментальных биологических препаратов высокой степени риска отличается от процедуры для других препаратов (увеличена продолжительность рассмотрения подобных исследований, клинические исследования генетических препаратов должны быть разрешены Консультативным комитетом по генетической терапии (GTAC)).
Для проведения исследований препаратов белкового происхождения и моноклональных антител предусмотрены дополнительные требования к исследователю. Например, он должен уметь купировать иммунные реакции, в т.ч. анафилактические. Многие белки характеризуются длительным периодом полувыведения и требуют редкого приема пациентами. Поэтому для получения исчерпывающей картины о фармакокинетическом профиле и достоверной оценки иммунного ответа необходимо обеспечить достаточный период последующего наблюдения – 3 месяца или даже дольше.
Потенциальные ЛС, имеющие биологическое происхождение, относят к препаратам с более высоким риском, чем другие исследуемые препараты.
К биологическим лекарственным средствам повышенного риска относятся:
• любые соединения, способные вызвать тяжелое нарушение жизненно важных систем организма;
• препараты с агонистическим или стимулирующим действием;
• новые препараты или механизмы действия, для которых нет предшествующего опыта использования;
• видоспецифичные препараты, из-за которых доклиническая оценка риска осложнена или невозможна;
• сильнодействующие препараты, например, по сравнению с естественными лигандами;
• многофункциональные препараты, например двухвалентные антитела;
• мишени, связанные с клетками;
• мишени, действующие в обход нормальных механизмов регуляции;
• мишени иммунной системы;
• мишени в системах с потенциалом значительного биологического усиления in vivo.
Термин «повышенный риск» подразумевает, что оценка ЛС должна быть еще более тщательной и качественной, чем обычно, и не означает, что риск для субъектов может быть выше минимального.
(Обращаю внимание, что за исключением максимум двух пунктов, всё перечисленное в этом перечне подтверждает разрабатываемую классификацию субъединичной вакцины, как лекарство с повышенным риском. Для того, что бы кандидату в лекарственный препарат оказаться в обозначенной категории, ему достаточно удовлетворять хотя бы одной позиции из списка)
Как правило, в первом исследования I фазы исследуются однократные дозы с возрастанием с целью оценки переносимости, безопасности, фармакокинетики и, если возможно, фармакодинамики исследуемого ЛС, а также сравнение результатов с выводами доклинических исследований. Последующие исследования I фазы – это исследования многократных возрастающих доз.
Сколько проходит времени от момента начала создания вакцины до запуска ее в массовое использование?
ОТВЕЧАЕТ ШАМШЕВА ОЛЬГА ВАСИЛЬЕВНА (Российский национальный исследовательский медицинский университет имени Н.И. Пирогова, Зав. кафедрой инфекционных болезней у детей: д.м.н., профессор)
Разработка вакцины более сложна и трудоёмка, чем других лекарственных препаратов. В целом, вакцины проходят еще более тщательную проверку, чем невакцинные препараты, поскольку лечебные препараты используются для лечения уже существующих патологических состояний, которые вызывают страдания пациента. Вакцины же предназначены для здоровых людей, для профилактики болезни. Поэтому клинические испытания (КИ) вакцин предназначены для изучения профилактического эффекта и безопасности. Число людей, включенных в клинические испытания, как правило, больше, чем у невакцинных препаратов. В среднем, срок разработки вакцины длится от 12 до 15 лет, хотя может быть значительно больше.
Разработка вакцины состоит из нескольких этапов: доклинические испытания, клинические испытания, фармакологический надзор/ наблюдательные исследования. Доклинические испытания – первый шаг к созданию эффективной и безопасной вакцины. Выбирается антиген и технология, то есть все вещества, которые используются при изготовлении вакцины. Проводятся испытания in-vitro (в пробирке) и in-vivo (на животных). Проверяется токсичность, общая и местная переносимость при введении доз, многократно превышающих предназначенные для человека и т.д. Полученная информация играет решающую роль в решении продолжать или нет работать с данной вакциной и начинать ли клинические испытания безопасности.
Если решение положительное, то начинается серия клинических испытаний. В первой фазе испытаний участвует небольшое число здоровых взрослых добровольцев (20-50).
Они вакцинируется и путем сравнения вакцины с контролем или неактивным веществом (плацебо, например, солевой раствор) оценивается безопасность, определяется безопасный диапазон доз, выявляются связанные с вакциной побочные эффекты. В той фазе также можно получить данные о временном интервале между прививками, которые приведут к оптимальному иммунному ответу. Первая фаза длится от 12 до 18 месяцев.
Если вакцина-кандидат продемонстрировала оптимальные результаты в первой фазе, то начинается вторая фаза. Вакцину-кандидат вводят большей группе людей (100-300) для дальнейшей оценки безопасности и иммуногенности. Этот этап предназначен для определения правильного режима дозировки и схемы введения и длится два года или более.
Третья фаза клинических испытаний проводится для наиболее перспективных вакцин, продемонстрировавших в предыдущих фазах безопасность и эффективность. В ней принимают участие от 3 до 5 тыс. человек, которым показана данная вакцина. Цель этого этапа - масштабные исследования безопасности и эффективности. Кроме того, на данном этапе исследуют одновременное назначение с другими вакцинами. Этот этап может длиться от 3 до 5 лет.
Четвертая фаза – это уже фармакологический надзор/ наблюдательные исследования. С момента начала применения вакцины проводятся мероприятия фармакологического надзора. Они предназначены для надзора за безопасностью вакцин, регистрации, понимания, оценки, предотвращения возможных нежелательных явлений и побочных действий иммунизации, а также других вопросов, связанных с вакцинами или вакцинопрофилактикой. Таким образом накапливаются факты и данные об эффективности и безопасности вакцины при применении ее в реальной жизни.
Также проводятся долговременные наблюдательные исследования для получения данных по эффективности вакцинации и продолжительности защиты.
Отмечу, что клинические исследования имеют ограничения. Не существует лекарственного препарата, к моменту регистрации которого имеются исчерпывающие сведения о свойствах, эффекте и безопасности. Основной недостаток исследований – ограничение вмешательствами, которые должны предположительно иметь положительный эффект. Другое ограничение - трудности интерпретации или обобщения результатов, потому что исследуемая группа людей всегда будет отличаться от людей, которым будут применять препарат в реальной жизни. Ограничение также обусловлено спецификой поставленных для клинического исследования задач - они определены и достаточно узки. Поэтому в стороне останется информация о влиянии на качество жизни, на удовлетворенность пациента, его расходы и т. п. Клинические испытания часто не обеспечивают ответы на вопросы, задаваемые врачами - практиками и людьми, принимающими решения. В идеале должны быть разработаны подходы к контролю заболевания с проведением долговременных наблюдений за тысячами пациентов в реальной жизни.
Фармаконадзор это один из инструментов накопления данных. На основе этих данных могут быть внесены изменения в инструкцию по применению препарата или другие действия, в том числе и снятие препарата с рынка.
Источник: Специалисты о прививках
Характерный пример создания вакцины от давно известного патогена.
Сейчас от гемофильной палочки бесплатно прививают только детей из группы риска (например, недоношенных, детей с ВИЧ или онкологическими заболеваниями). Минздрав же планирует ввести вакцинацию для всех детей. Гемофильная инфекция проявляется в виде гнойного менингита, отита, заболеваний дыхательных путей (пневмония, бронхит), приводит к поражениям сердца и суставов.
Зав. лабораторией вакцинопрофилактики и иммунотерапии аллергических заболеваний НИИ вакцин и сывороток имени Мечникова Михаил Костинов рассказал, что в России не могли позволить себе массовую вакцинацию против гемофильной инфекции, потому что вакцины нужно было закупать за рубежом. Отечественную вакцину разрабатывали 15 лет, и сейчас она должна выйти на массовое производство, пояснил Михаил Костинов.
Каковы риски на всех этапах разработки вакцин?
Каждый из этих этапов далеко не так прост, как кажется. Неудача может случиться на любом из них, но самое сложное - клинические испытания эффективности и безопасности. Так, в 1995 г. из 190 вакцин, которые разрабатывались в США, получили лицензию только 5.
Известно, что большинство (порядка 90%) новейших лекарственных препаратов, которые достигают стадии клинических испытаний, эти испытания не проходят. Даже при достижении III стадии — а до нее добираются только лекарства, которые, очевидно, благополучно прошли отбор на предыдущих этапах — процент неудачи составляет 40%. Разработка лекарства — это уникальная комбинация крайне высокой законодательной нагрузки и очень высокого процента неудач, так что имеется соблазн сказать, что именно жесткое законодательство служит причиной провалов испытаний. Но это не так. Причина — в невероятной сложности процесса.
Свежие примеры приведённого выше тезиса.
17 ИЮНЯ 2021
Немецкая вакцина CureVac провалилась на промежуточной стадии испытаний
Вакцина-кандидат CVnCoV немецкого производителя CureVac (вакцина для самого модного заболевания) по результатам второй фазы промежуточных испытаний не достигла ожидаемых результатов эффективности. Об этом биофармацевтическая компания со штаб-квартирой в университетском городе Тюбингене сообщила в среду, 17 июня.
«В беспрецедентных до сегодняшнего дня условиях, связанных с наличием как минимум 13 вариантов вируса, в группе участников испытаний по результатам промежуточного анализа была выявлена предварительная эффективность в 47 процентов по отношению к заболеванию COVID-19 всех уровней тяжести. Таким образом, статистически вакцина-кандидат не выполнила критериев для признания испытаний успешными», – говорится в документе. По данным CureVac, первые промежуточные анализы показали, что эффективность вакцины зависит от возраста участников испытаний и штаммов вируса.

Во вторых, даже у препарата уже получившего регистрацию и продолжительное время продающийся на рынке многих стран может быть выявлен побочный эффект и он будет запрещён к продаже. Характерный пример. Во Франции из-за лекарства тысячи детей появились на свет с врожденными пороками.
Отличная иллюстрация о сроках разработки инновационных препаратов на принципиально новой платформе.
После почти 20 лет исследований некогда многообещающих лекарств от рака, известных как ингибиторы MMP, они внезапно потерпели неудачу в клинических испытаниях и ученые сегодня стремятся дать этому объяснение.
Несмотря на многообещающие результаты применения ингибиторов ММР у мышей, они не были успешными для людей, у некоторых пациентов развились серьезные побочные эффекты. Результаты были опубликованы в издании «Developmental Cell».
Вернёмся к проблемам разработки субъединичных вакцин.
Субъединичные вакцины представляют собой вирусный антиген, выделяемый из вирусного препарата или полученный рекомбинантным способом. Классическим примером субъединичной вакцины, является вакцины от гриппа, закупаемые государством (Гриппол, Гриппол Плюс)
В субъединичных вакцинах используются только специфические фрагменты (субъединицы) вируса или бактерии, которые иммунная система должна распознать. Они не содержат цельных микроорганизмов или безопасных вирусов в качестве вектора. В качестве субъединиц могут использоваться белки или сахара. Большинство вакцин, применяемых в календаре детских прививок, являются субъединичными и защищают от таких болезней, как коклюш, столбняк, дифтерия и менингококковый менингит.

Характерным примером субъединичной вакцины является «ЭпиВакКорона»
Такие препараты создаются на основе различных антигенных компонентов – субъединиц. Можно взять, к примеру, часть оболочки вируса — белки, которые отвечают за проникновение вируса в клетку. У коронавируса это S-белок. И хотя антитела при введении такой вакцины будут вырабатываться непосредственно на белок, уровень иммунного ответа и качество защитных антител, скорее всего, будет ниже, чем на векторную или цельновирионную вакцины. На целый вирус или кусочек генома вырабатываются более сложные по структуре антитела, чем на изолированный белок. Но надо понимать, что, говоря «белок», мы немного утрируем — там может использоваться много структур, включая поверхностную и внутреннюю мембрану, белки-носители и так далее.
В чем минусы таких вакцин? Поверхностный белок может со временем мутировать, и будет ли вакцина эффективна, скажем, через год — вопрос. Для усиления иммунного ответа в них так же, как и в цельвирионных, используются адъюванты. Адъюванты - вещества, усиливающие иммунный ответ, за счет активации клеток иммунной системы, что позволяет сократить количество антигена в дозе вакцины. Адъювант способствует созданию "депо" антигена в месте инъекции для увеличения продолжительности контакта антигена с иммунной системой. В качестве адъюванта в течение почти девяноста лет широко применяются соли алюминия (фосфат алюминия-калия или сульфат алюминия-калия), усиливающие иммунный ответ на белок. В некоторых сравнительно новых вакцинах в качестве адъювантов, используются водно-масляные эмульсии (ASO3 и ASO4), пептидогликан, азоксимера бромид («Полиоксидоний)». Вопрос о том, какие вакцины эффективнее – адъювантные или безадъювантные – до сих пор вызывает споры, как впрочем и вопрос о безвредности адъювантов абсолютно для всех пациентов.
Как было отмечено раньше, необходимой и наиболее существенной частью Клинических испытаний является Фаза III. Многоцентровые испытания с участием больших (и, по возможности, разнообразных) групп пациентов. В последнее время появился термин "мегаисследования" (megatrials), в которых могут принимать участие свыше 10000 пациентов. Исследования III фазы проводят с целью получения дополнительных данных о безопасности и эффективности различных форм препарата. В ходе III фазы изучают характер наиболее частых нежелательных реакций, клинически значимые лекарственные взаимодействия, влияние возраста, сопутствующих состояний и т.д.
Обычно клинические испытания этой фазы являются двойными слепыми контролируемыми рандомизированными исследованиями. Условия исследований максимально приближены к нормальным условиям применения препарата. Данные, полученные в клинических испытаниях III фазы, являются основой для создания инструкции по применению препарата и важным фактором для принятия официальными инстанциями решения о регистрации лекарственного средства и возможности его медицинского использования. Выделяют IIIb фазу клинических испытаний, к которой относят исследования, проходящие в период от подачи материалов для регистрации препарата в официальные инстанции до момента регистрации и получения разрешения на медицинское применение. Они проводятся для того, чтобы получить некоторые дополнительные сведения о препарате, оценить качество жизни, положение будущего препарата на рынке и т.д.
Именно эта фаза должна дать окончательный ответ на возможность регистрации и дальнейшего применения разрабатываемой вакцины. Будем надеяться, что у разработчиков хватит ресурса, времени, а контролирующие органы ДОБРОСОВЕСТНО выполнят свою работу по надзору (что находиться под большим вопросом по результатам регистрации предыдущих отечественных вакцин от ковид).
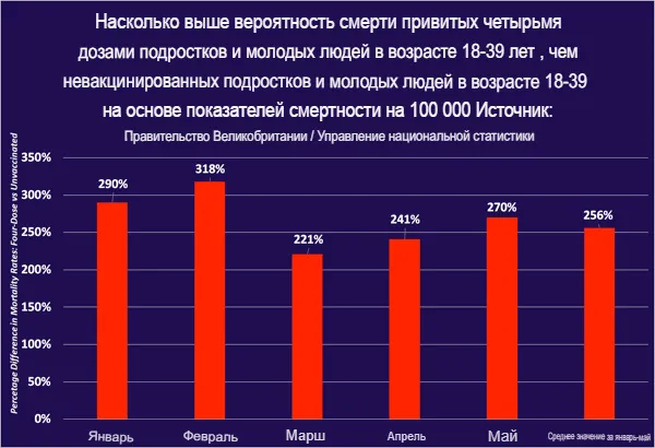
P.S. надеюсь, что подсказка о том, как персонально уменьшить риски для здоровья при ковровой вакцинации станет для читателя прозрачнее.


























Оценили 66 человек
115 кармы