Пожалуй, многие читатели осознают, что все гомо сапиенсы нафаршированы микроорганизмами гораздо плотнее чем самый крутой кекс цукатами и изюмом в соотношении того, что можно отнести непосредственно к человеку, а что есть исключительная прерогатива микроорганизмов В и НА человеке. Эта тема роскошно раскрыта в лекции Бонни Баззлер «Как разговаривает бактерия», которую можно посмотреть на YouTube или прочитать в моем переводе с картинками.
https://www.ted.com/talks/bonnie_bassler_how_bacteria_talk?user_email_address=641ce4a182bc400772d9d185ffe1cbeb&subtitle=en
https://cont.ws/@h5n1/1270177

Взаимодействие биологического микромира с хозяином из многоклеточного макромира невероятно сложная вещь, еще плохо изученная. Но есть отчётливое понимание и механизмы воздействия на микромир, приводящие к серьёзным последствиям для хозяина этого микромира.
В начале 1900-х годов Шарль Рише продемонстрировал, что анафилаксия — это реакция на токсиген, любой белок, непосредственно введённый в кровь. Белок не обязательно должен быть ядом, он может быть безвредным (пищевым). Ключевым моментом является инъекция, которая вызывает состояние гиперчувствительности или анафилаксию у непредсказуемого процента испытуемых. Анафилаксия — это реакция кишечника на чужеродные белки в кровотоке:


В недавней рецензируемой научной статье международной группы авторов была предложена очень убедительная гипотеза о том, как вакцинация от COVID-19 разрушает микробиом кишечника, вызывая множество хронических и смертельных заболеваний. Я привожу ключевые фрагменты с некоторыми комментариями. Статью можно найти здесь:
COVID 2024, 4(9), 1368-1378; https://doi.org/10.3390/covid4090097
Аннотация
Появление мРНК-вакцин от SARS-CoV-2 открыло новую страницу в разработке вакцин. Тем не менее, эксперты высказывают опасения по поводу непреднамеренных побочных эффектов, оздействующих на микробиоту кишечника (МК). Предыдущие исследования показали, что этот вирус действует как бактериофаг, который заражает и уничтожает определённые штаммы бактерий в МК. В данной статье выдвигается гипотеза о том, что синтетический белок-шип может изменять состав и функционирование МК, проникая в клетки кишечника после вакцинации и нарушая симбиотические отношения между клетками кишечника и МК. Предлагается вниманию экспериментальный протокол для проверки этой гипотезы.
Спайковый белок вакцин, особенно в его свободной форме, может быть способен вызывать те же воспалительные каскады, что и спайковый белок SARS-CoV-2 [22,23,24]. В течение как минимум десятилетия научная литература документировала и широко признавала воспалительную токсичность спайкового белка [25,26,27]. Наличие рецепторов ACE2 практически во всех частях тела, включая глотку, трахею, лёгкие, кровь, сердце, сосуды, кишечник, мозг, мужские половые органы, почки и сперму, а также в биологических жидкостях, таких как слизь, слюна, моча, спинномозговая жидкость и грудное молоко, является вторым фактором, который делает взаимодействие шиповидного белка с ACE2 более токсичным [28]. Таким образом, шиповидный белок может вызывать воспаление в различных органах и системах. На самом деле, помимо проблем с дыханием, у большинства пациентов с COVID-19 также наблюдаются неврологические, сердечно-сосудистые, кишечные и почечные нарушения [29,30,31,32,33].Поскольку белок-шип содержится в SARS-CoV-2, а также вырабатывается в ответ на мРНК-вакцины, такая токсичность, следовательно, может быть вызвана как тяжёлыми формами и длительным COVID-19, так и всеми вакцинами, основанными на нерегулируемом синтезе белка-шипа различными клетками, в отличие от вакцин, изготовленных из инактивированного целого вируса или на основе инактивированного белка-шипа [22].
Известно, что после инъекции мРНК-вакцины спайк-белок присутствует на поверхности клеток, а также в значительных количествах в свободной форме в кровотоке, который поступает в различные органы, такие как кровь [34,35,36], печень [37,38], легкие [37,39], почки [37,39], лимфа. узлы [40,41,42], селезенка [37,39], сердце [37,42] и головной мозг [37,43]. (Для механизма ДНК вакцины презентация спай белка на поверхности клеток является основным механизмом активации иммунной системы. Подробнее здесь: https://cont.ws/@h5n1/2599660 Прим. Автора)Недавнее исследование показало, что 50% исследованных образцов крови содержали синтетический шиповидный белок, который трудно расщепить. Интервалы между иммунизацией и обнаружением шиповидного белка, полученного из вакцины, составили 69 и 187 дней соответственно [36]. Кроме того, было показано, что как весь белок-шип, так и субъединица S1, которая включает в себя домен, связывающийся с рецептором ACE2 (RBD), могут взаимодействовать с рецепторами ACE2, вырабатываемыми различными типами клеток, такими как эндотелиальные клетки и тромбоциты, и вызывать воспалительную реакцию [43,44].Спайковый белок вреден не только потому, что он связывается с рецепторами ACE2, но и потому, что он взаимодействует с генами-супрессорами рака P53 и BRCA, повреждает митохондрии, вызывает коагулопатию при прямом контакте с клеточными белками, накапливается и распространяется в виде прионных белков в их патологической форме и является нейротоксичным, поскольку накопление спайкового белка внутри клеток может также вызывать апоптоз [45].
Исследования показали, что количество родов Bifidobacterium и Faecalibacterium значительно снижается в кишечнике как с помощью SARS-CoV-2 [46], так и с помощью мРНК-вакцин [47]. Чтобы оценить относительную численность бифидобактерий в кишечнике, Хазан и др. [47] взяли образцы кала у 34 человек как до, так и через месяц после иммунизации. Их относительная численность резко снизилась примерно до 50% от исходного уровня. Род Bifidobacterium имел средние значения относительной численности 1,13% до и 0,64% после вакцинации [47].
Гипотеза
В настоящей работе предполагается, что синтетический белок-шип может проникать в клетки кишечника и вызывать воспалительную реакцию, тем самым нарушая хрупкий баланс между GM и клетками кишечника. Такой дисбиоз может привести к дисфункции или даже гибели этих полезных бактерий (рис. 1).
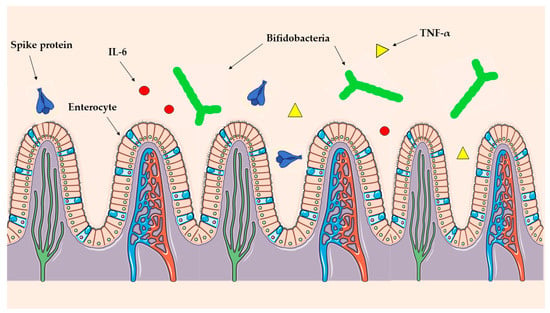
Рисунок 1. Синтетический белок-шип может связываться с рецепторами ACE2 на энтероцитах кишечника, потенциально вызывая высвобождение провоспалительных цитокинов, таких как IL-6 и TNF-α. Такие нарушения могут изменять среду кишечника, негативно влияя на полезные бактерии и способствуя росту патогенных бактерий.
Спайковый белок SARS-CoV-2 связывается с рецептором ACE2, который также экспрессируется на поверхности энтероцитов в кишечнике [48]. Это взаимодействие потенциально может нарушить эпителиальный барьер кишечника, приводя к повышенной проницаемости кишечника ("дырявый кишечник"), как продемонстрировано при MIS-C, редком, но тяжелом осложнении инфекции SARS-CoV-2 [49]. Связывание синтетического шиповидного белка с рецепторами ACE2 на энтероцитах может вызвать воспалительную реакцию, приводящую к высвобождению провоспалительных цитокинов, таких как IL-6 и TNF-α. Такие нарушения могут также изменить микрофлору кишечника, сделав её менее благоприятной для полезных бактерий и способствуя росту патогенных видов.
Другим последствием, связанным со связыванием шиповидного белка SARS-CoV-2 с рецепторами ACE2, является дефицит триптофана (Trp). ACE2 играет важную роль в усвоении Trp, выступая в качестве шаперона для переносчика аминокислот BOAT1 [50,51]. Исследования показали, что у животных с нокаутированным ACE2 уровень аминокислот в сыворотке крови ниже, особенно Trp. Наряду с этим снижением уровня триптофана наблюдалось значительное снижение уровня противомикробного пептида (α-дефензина) и дисбактериоз кишечника. Негативные последствия, вызванные дефицитом ACE2, были устранены путём добавления триптофана непосредственно в рацион, что продемонстрировало, что серьёзное нарушение локального гомеостаза триптофана, вызванное дефицитом ACE2, повышает восприимчивость к воспалению кишечника [52]. Предполагается, что искусственно созданный шиповидный белок может делать то же самое.
Синтетический шиповидный белок может также воздействовать на ассоциированную с кишечником лимфоидную ткань (GALT), ключевой компонент иммунной системы в кишечнике [53]. Поскольку такие факторы, как возраст, диета, ранее существовавшие заболевания и генетическая предрасположенность, могут влиять на GM и его реакцию на вакцинацию, в этой работе предлагается проверить гипотезу на животной модели, в которой эти переменные можно легко контролировать.
ИТОГО:
Подтверждая гипотезу о разрушении микробиома кишечника всеми вакцинами (не только от COVID), ещё одна рецензируемая статья показала, что микробиом кишечника у детей с аутизмом сильно отличается от микробиома кишечника у обычных детей. Примечание: я терпеть не могу такие отвратительные слова, как «нейротипичный» или «нейроразнообразный». Есть здоровые обычные дети, а есть намеренно искалеченные дети с аутизмом. Преступный картель, который травит наших детей, продвигает отвратительную терминологию, призванную увековечивать ложь о том, почему и как эти дети навсегда искалечены. Не поддавайтесь на их лживый язык.
К черту факты!
Мораль этой истории такова, что факты просто не имеют значения, когда речь идет о политической и финансовой повестке дня. Правительство лжет, уступчивые ученые, ищущие финансирования, поддерживают нарратив, проводя научно-мимикрирующую деятельность, а основные СМИ послушно фабрикуют согласие с преступной политикой правительства вместо того, чтобы заниматься журналистикой.
Список литературы
22. Лесгард, Ж.-Ф.; Сердан, Д.; Перронн, К.; Сабатье, Ж.-М.; Азалберт, К.; Роджерс, Э.А.; Маккалоу, П.А. Токсичность шиповидного белка SARS-CoV-2, полученного из вируса и мРНК-вакцины против COVID-19 или аденовирусной ДНК-вакцины. Microbiol. Immunol. 2023, 7, 121–138. [Google Scholar] [CrossRef]
23. Парри, П.И.; Лефрингхаузен, А.; Турни, К.; Нил, К.Дж.; Косфорд, Р.; Хадсон, Н.Дж.; Гиллеспи, Дж. «Спайкопатия»: белок-шип COVID-19 является патогенным как для вируса, так и для мРНК вакцины. Biomedicines 2023, 11, 2287. [Google Scholar] [CrossRef]
24. Козенто, М.; Марино, Ф. Понимание фармакологии мРНК-вакцин от COVID-19: игра в кости с шиповидным белком? Int. J. Mol. Sci. 2022, 23, 10881. [Google Scholar] [CrossRef]
25. Ксиасек, Т.Г.; Эрдман, Д.; Голдсмит, К.С.; Заки, С.Р.; Перет, Т.; Эмери, С.; Тонг, С.; Урбани, К.; Комер, Дж.А.; Лим, У. Новый коронавирус, связанный с тяжелым острым респираторным синдромом. N. Engl. J. Med. 2003, 348, 1953–1966. [Google Scholar] [CrossRef] [PubMed]
26. Пейрис, Дж. С. М.; Чу, К.-М.; Ченг, В. К.-К.; Чан, К.; Хунг, И.; Пун, Л. Л.; Лоу, К.-И.; Танг, Б.; Хон, Т.; Чан, К. Клиническое течение и вирусная нагрузка при вспышке коронавирусной пневмонии, вызванной атипичной пневмонией: проспективное исследование. Lancet 2003, 361, 1767–1772. [Google Scholar] [CrossRef]
27. Курт-Джонс, Э.А.; Дудек, Т.Э.; Ватанабе, Д.; Манделл, Л.; Че, Дж.; Чжоу, С.; Цао, Л.; Гриноу, Т.; Бэбкок, Г.Дж.; Диас, Ф. Экспрессия шиповидного белка коронавируса SARS-1 из герпесвирусного вектора вызывает передачу сигналов врожденного иммунитета и выработку нейтрализующих антител. Вирусология 2021, 559, 165–172. [Google Scholar] [CrossRef]
28. Трюпстин, В.; Ван Климпут, Дж.; Сниппенберг, В.в.; Герло, С.; Вандекеркхов, Л. О местонахождении SARS-CoV-2 в организме человека: систематический обзор. PLoS Pathog. 2020, 16, e1009037. [Google Scholar] [CrossRef] [PubMed]
29. Ардженциано, М.Г.; Брюс, С.Л.; Слейтер, К.Л.; Тио, Дж.Р.; Болдуин, М.Р.; Барр, Р.Г.; Чанг, Б.П.; Чау, К.Х.; Чой, Дж.Дж.; Гэвин, Н. Характеристика и клиническое течение болезни у 1000 пациентов с коронавирусной инфекцией 2019 года в Нью-Йорке: ретроспективный анализ клинических случаев. BMJ 2020, 369, m1996. [Google Scholar] [Перекрестная ссылка]
30. Хуан, Ц.; Ван, Ю.; Ли, С.; Жэнь, Л.; Чжао, Дж.; Ху, Ю.; Чжан, Л.; Фань, Г.; Сюй, Дж.; Гу, С. Клинические особенности пациентов, заразившихся новым коронавирусом в 2019 году в Ухане, Китай. Lancet 2020, 395, 497–506. [Google Scholar] [CrossRef]
31. Лин, Л.; Цзян, С.; Чжан, З.; Хуан, С.; Чжан, З.; Фан, З.; Гу, З.; Гао, Л.; Ши, Х.; Май, Л. Желудочно-кишечные симптомы у 95 пациентов с инфекцией SARS-CoV-2. Gut 2020, 69, 997–1001. [Google Scholar] [CrossRef] [PubMed]
32. Чу, К.Х.; Цанг, В.К.; Танг, К.С.; Лам, М.Ф.; Лай, Ф.М.; То, К.Ф.; Фунг, К.С.; Танг, Х.Л.; Ян, В.В.; Чан, Х.В. Острая почечная недостаточность при тяжелом остром респираторном синдроме, вызванном коронавирусом. Kidney Int. 2005, 67, 698–705. [Google Scholar] [CrossRef] [PubMed]
33. Мао Л.; Цзинь Х.; Ван М.; Ху Ю.; Чен С.; Хэ Ц.; Чанг Дж.; Хонг К.; Чжоу Ю.; Ван Д. Неврологические проявления у госпитализированных пациентов с коронавирусной болезнью 2019 в Ухане, Китай. JAMA Neurol. 2020, 77, 683–690. [Google Scholar] [CrossRef]
34. Каструита, Дж. А. С.; Шнайдер, У. В.; Моллеруп, С.; Лейневебер, Т. Д.; Вайс, Н.; Бух, Дж.; Педерсен, М. С.; Вест, Х. Последовательности мРНК-вакцины против шиповидного белка SARS-CoV-2 циркулируют в крови до 28 дней после вакцинации от COVID-19. Apmis 2023, 131, 128–132. [Google Scholar] [CrossRef] [PubMed]
35. Бансал С.; Перинчери С.; Флеминг Т.; Поулсон К.; Тиффани Б.; Бремнер Р.М.; Моханакумар Т. Передовая статья: циркулирующие экзосомы с шиповидным белком COVID индуцируются вакциной BNT162b2 (Pfizer–BioNTech) до выработки антител: новый механизм активации иммунитета мРНК-вакцинами. J. Immunol. 2021, 207, 2405–2410. [Google Scholar] [Перекрестная ссылка] [PubMed]
36. Бронья, К.; Кристони, С.; Марино, Г.; Монтано, Л.; Видуто, В.; Фабровски, М.; Леттьери, Г.; Пископо, М. Обнаружение рекомбинантного белка-шипа в крови людей, вакцинированных против SARS-CoV-2: возможные молекулярные механизмы. PROTEOMICS–Clin. Appl. 2023, 17, 2300048. [Google Scholar] [CrossRef]
37. Брудик, К.; Лоран, С.; Перков, В.; Саймон, К.; Гаринот, М.; Трушо, Н.; Латур, Ж.; Дезер, П. Доклиническая оценка безопасности вакцины-кандидата на основе мРНК против COVID-19 после многократного введения и биораспределения. J. Appl. Toxicol. 2024, 44, 371–390. [Google Scholar] [CrossRef]
38. Хассетт, К.Дж.; Бененато, К.Э.; Жакенет, Э.; Ли, А.; Вудс, А.; Южаков, О.; Химансу, С.; Детерлинг, Дж.; Гейлих, Б.М.; Кетова, Т. Оптимизация липидных наночастиц для внутримышечного введения мРНК-вакцин. Mol. Ther.-Нуклеиновые кислоты 2019, 15, 1–11. [Google Scholar] [CrossRef]
39. Райхмут, А.М.; Оберли, М.А.; Якленек, А.; Лангер, Р.; Бланкштейн, Д. Доставка мРНК-вакцины с помощью липидных наночастиц. Ther. Deliv. 2016, 7, 319–334. [Google Scholar] [CrossRef]
40. Рёльтген, К.; Нильсен, С.К.; Сильва, О.; Юнес, С.Ф.; Заславский, М.; Косталес, К.; Янг, Ф.; Вирц, О.Ф.; Солис, Д.; Хо, Р.А. Иммунный импринтинг, широта распознавания вариантов и реакция зародышевых центров при заражении человека SARS-CoV-2 и вакцинации. Cell 2022, 185, 1025–1040.e1014. [Google Scholar] [Перекрестная ссылка]
41. Линдсей, К.Э.; Бхосле, С.М.; Зурла, К.; Бейерсдорф, Дж.; Роджерс, К.А.; Вановер, Д.; Сяо, П.; Араинга, М.; Ширрефф, Л.М.; Питард, Б. Визуализация ранних этапов доставки мРНК-вакцины у нечеловекообразных приматов с помощью ПЭТ-КТ и ближней инфракрасной визуализации. Nat. Biomed. Eng. 2019, 3, 371–380. [Google Scholar] [Перекрестная ссылка] [PubMed]
42. Краусон, А.Дж.; Касимеро, Ф.В.К.; Сиддики, З.; Стоун, Дж.Р. Продолжительность действия мРНК-вакцины против SARS-CoV-2 и факторы, связанные с поражением сердца у недавно вакцинированных пациентов. npj Vaccines 2023, 8, 141. [Google Scholar] [CrossRef]
43. Анджели, Ф.; Спаневелло, А.; Ребольди, Г.; Виска, Д.; Вердеккиа, П. Вакцины против SARS-CoV-2: свет и тени. Eur. J. Intern. Med. 2021, 88, 1–8. [Google Scholar] [CrossRef] [PubMed]
44. Чжан С.; Лю Ю.; Ван С.; Ян Л.; Ли Х.; Ван Ю.; Лю М.; Чжао С.; Се Ю.; Ян Ю. SARS-CoV-2 связывается с ACE2 тромбоцитов, усиливая тромбоз при COVID-19. J. Hematol. Oncol. 2020, 13, 120. [Google Scholar] [CrossRef] [PubMed]
45. Сенефф С.; Кириакопулос А.М.; Най Г.; МакКаллоу П.А. Потенциальная роль белка-шипца в нейродегенеративных заболеваниях: обзорная статья. Cureus 2023, 15, e34872. [Google Scholar] [CrossRef]
46. Хазан С.; Столлман Н.; Бозкюрт Х.С.; Дэйв С.; Папуцис А.Дж.; Дэниелс Дж.; Барроуз Б.Д.; Куигли Э.М.; Бороди Т.Дж. Потерянные микробы при COVID-19: истощение популяции бифидобактерий и фекальных бактерий и снижение разнообразия микробиома, связанные с тяжестью инфекции SARS-CoV-2. BMJ Open Gastroenterol. 2022, 9, e000871. [Google Scholar] [Перекрестная ссылка]
47. Хазан С.; Дэйв С.; Бэрроуз Б.; Бороди Т.Дж. Вакцины на основе матричной РНК SARS-CoV-2 S227 влияют на микробиом кишечника. Off. J. Am. Coll. Гастроэнтерол. | ACG 2022, 117, e162. [Google Scholar] [CrossRef]
48. Хикмет, Ф.; Меар, Л.; Эдвинссон, О.; Микке, П.; Улен, М.; Линдског, К. Профиль экспрессии белка ACE2 в тканях человека. Mol. Syst. Biol. 2020, 16, e9610. [Google Scholar] [CrossRef]
49. Йонкер, Л.М.; Гилбоа, Т.; Огата, А.Ф.; Сенусси, И.; Лазаровиц, Р.; Борибонг, Б.П.; Барч, И.К.; Луазель, М.; Ривас, М.Н.; Порритт, Р.А.; и др. Мультисистемный воспалительный синдром у детей вызван потерей зонулин-зависимого барьера слизистой оболочки кишечника. J. Clin. Исследования. 2021, 131, e149633. [Google Scholar] [CrossRef] [PubMed]
50. Камарго, С.М.; Сингер, Д.; Макридес, В.; Хаггель, К.; Пос, К.М.; Вагнер, К.А.; Куба, К.; Данильчик, У.; Сковби, Ф.; Клета, Р. Тканеспецифические переносчики аминокислот ACE2 и коллекторрин по-разному взаимодействуют с мутациями hartnup. Гастроэнтерология 2009, 136, 872–882.e873. [Google Scholar] [CrossRef]
51. Стивенс, Б.Р.; Эллори, Дж.К.; Престон, Р.Л. Транспортер аминокислот B0AT1 в комплексе с рецептором ACE2 вируса SARS-CoV-2 образует функциональную гетеродимерную единицу: конформация in situ с использованием анализа радиационной инактивации. Функция 2021, 2, zqab027. [Google Scholar] [CrossRef] [PubMed]
52. Хасимото, Т.; Перло, Т.; Рехман, А.; Тришеро, Ж.; Исигуро, Х.; Паолино, М.; Сигл, В.; Ханада, Т.; Ханада, Р.; Липински, С. ACE2 связывает аминокислотное недоедание с микробной экологией и воспалением кишечника. Nature 2012, 487, 477–481. [Google Scholar] [CrossRef]
53. Косола, К.; Роккетти, М.Т.; Джезуальдо, Л. Микробиота кишечника, иммунная система и цитотоксические Т-лимфоциты. Цитотоксические Т-клетки: методы и протоколы. 2021, 2325, 229–241. [Google Scholar]





























Оценили 34 человека
67 кармы