Авторы: Александр Коротаев, Ольга Волкова
Редакторы: Чугунов Антон, Панов Андрей.
Инфографика выполнена совместно с Павлом Чирковым, магистром факультета политологии Санкт-Петербургского государственного университета.
Текст Ольга Волкова.
Источник: Биомолекула.
Как устроена иммунная система прокариот?
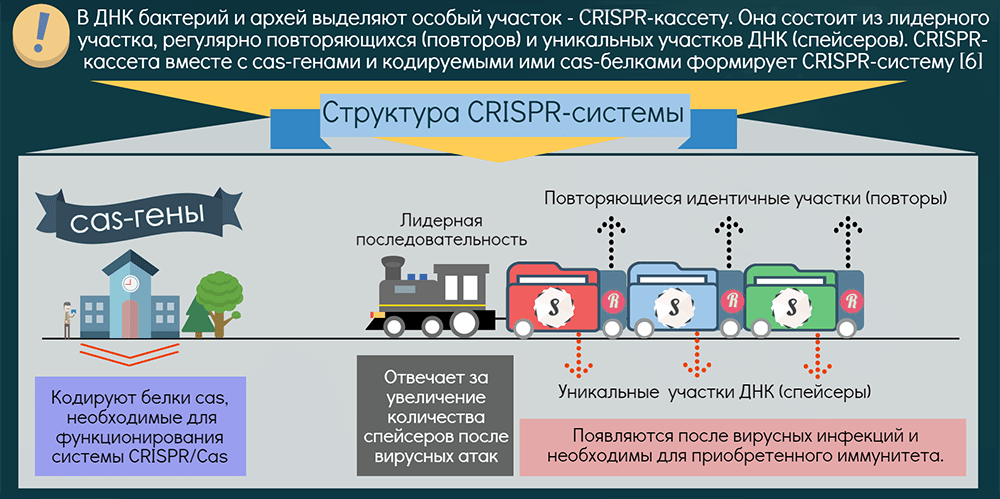
Системы CRISPR-Cas обнаружены почти у всех известных архей и половины бактерий. Чаще они находятся на хромосоме, реже — в составе фагов (вирусов бактерий) и других мобильных генетических элементов. Эти системы состоят из двух основных блоков: CRISPR-кассеты и прилегающего к ней кластера генов cas. Кассета — это блок прямых почти палиндромных («зеркальных», взаимокомплементарных последовательностей, способных складываться в шпильки) повторов размером 24–48 пар нуклеотидов. Эти повторы перемежаются спейсерами — уникальными вставками примерно такой же длины. Спейсеры идентичны различным участкам фагов и других мобильных элементов, когда-либо проникавших в эту клетку или ее предков. Число повторов в разных системах варьирует от единиц до сотен.
Таким образом, CRISPR можно считать коллекцией разделенных повторами «фотографий» нарушителей клеточных границ. Составляется эта коллекция простым заимствованием их кусочков, а чтобы противостоять новой инвазии этих же молекулярных агентов, коллекция должна регулярно «просматриваться» и обновляться. Для этой функции нужна лидерная последовательность, предшествующая череде повторов. Она богата «легкоплавкими» АТ-пáрами и содержит промотор, контролирующий транскрипцию CRISPR-кассеты («просмотр коллекции»).
Гены cas кодируют белки, берущие на себя всю тяжесть работы по встраиванию спейсеров и уничтожению агентов с идентичными последовательностями (протоспейсерами) и помогающие процессировать CRISPR-транскрипт: разделять фото-гирлянду на отдельные портреты. Функцию уничтожения выполняют Cas-белки, называемые эффекторными. В зависимости от типа эффекторов все CRISPR-системы разделяют на два класса: у I класса мишень уничтожается мультибелковым комплексом, а у II — одним крупным белком. Далее эти классы подразделяются на шесть типов. Большинство эффекторов атакует ДНК, лишь один — исключительно РНК [10], редкие — обе молекулы. Один организм может содержать несколько разных систем, а спейсеры различаются в разных клетках даже одной популяции.
Для решения инженерных задач больше всего подходит система II типа, относящаяся ко II классу, — она самая простая. Именно ее эффекторный белок называется Cas9 — то самое обозначение, что фигурирует в современных системах редактирования генома.
Как формируется CRISPR-опосредованный иммунитет?
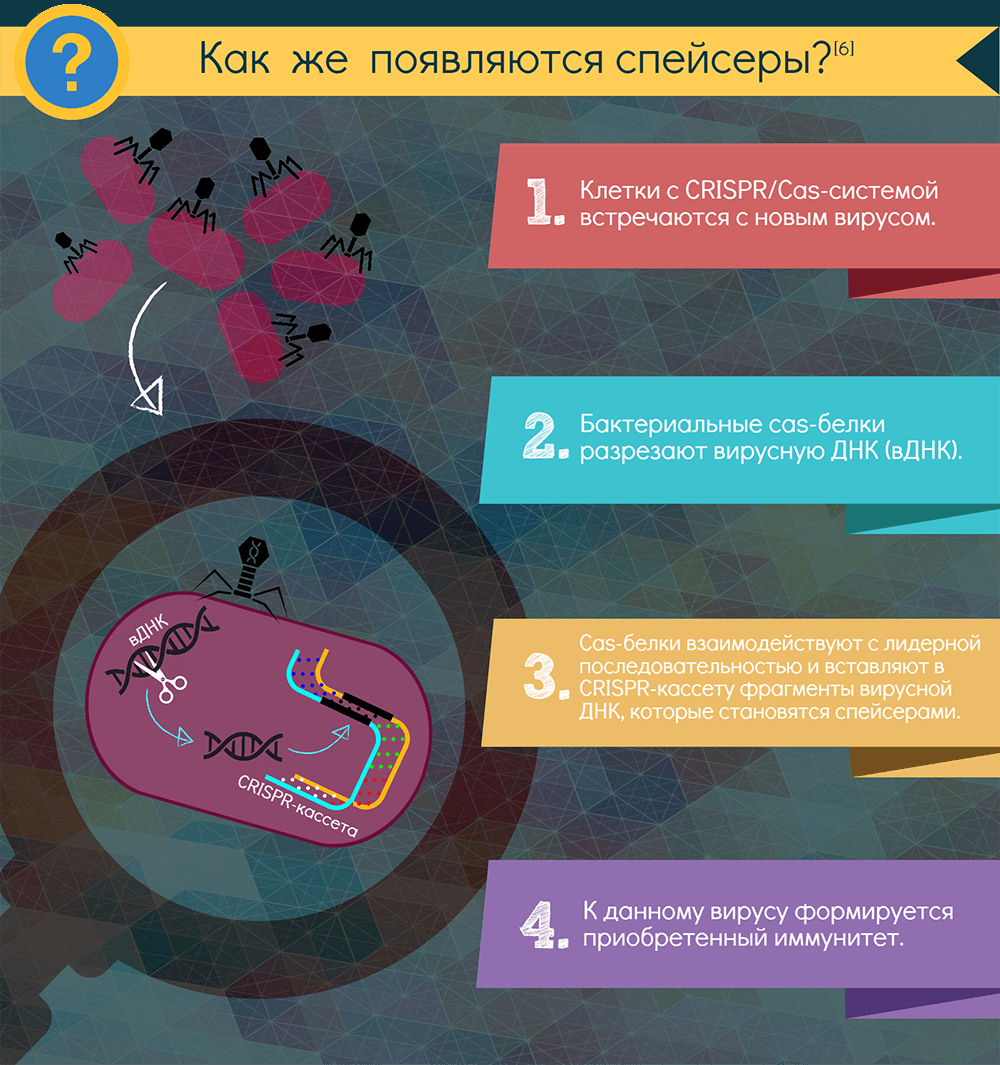
Если в бактерию или архею, снабженную CRISPR-системой, проникает вирус, включается адаптационный функциональный модуль системы: специфические Cas-белки — у всех систем это как минимум Cas1 и Cas2 — вырезают из чужака понравившиеся фрагменты. Подобрать протоспейсер в некоторых случаях помогает и эффекторный белок. Белки выбирают участки рядом с особой последовательностью PAM (proto-spacer adjacent motif) — всего несколько нуклеотидов, но неодинаковых для разных CRISPR-систем. Затем эти же адаптационные белки встраивают фрагмент в CRISPR-кассету, всегда с одной стороны — у лидерной последовательности. Так образуется новый спейсер, а заодно с ним — и новый повтор. Весь этот процесс называют адаптацией, или приобретением, а по сути это — запоминание врага. Информацию обо всех запомнившихся врагах получает при делениях всё потомство клетки.
Как реализуется CRISPR-опосредованный иммунитет?
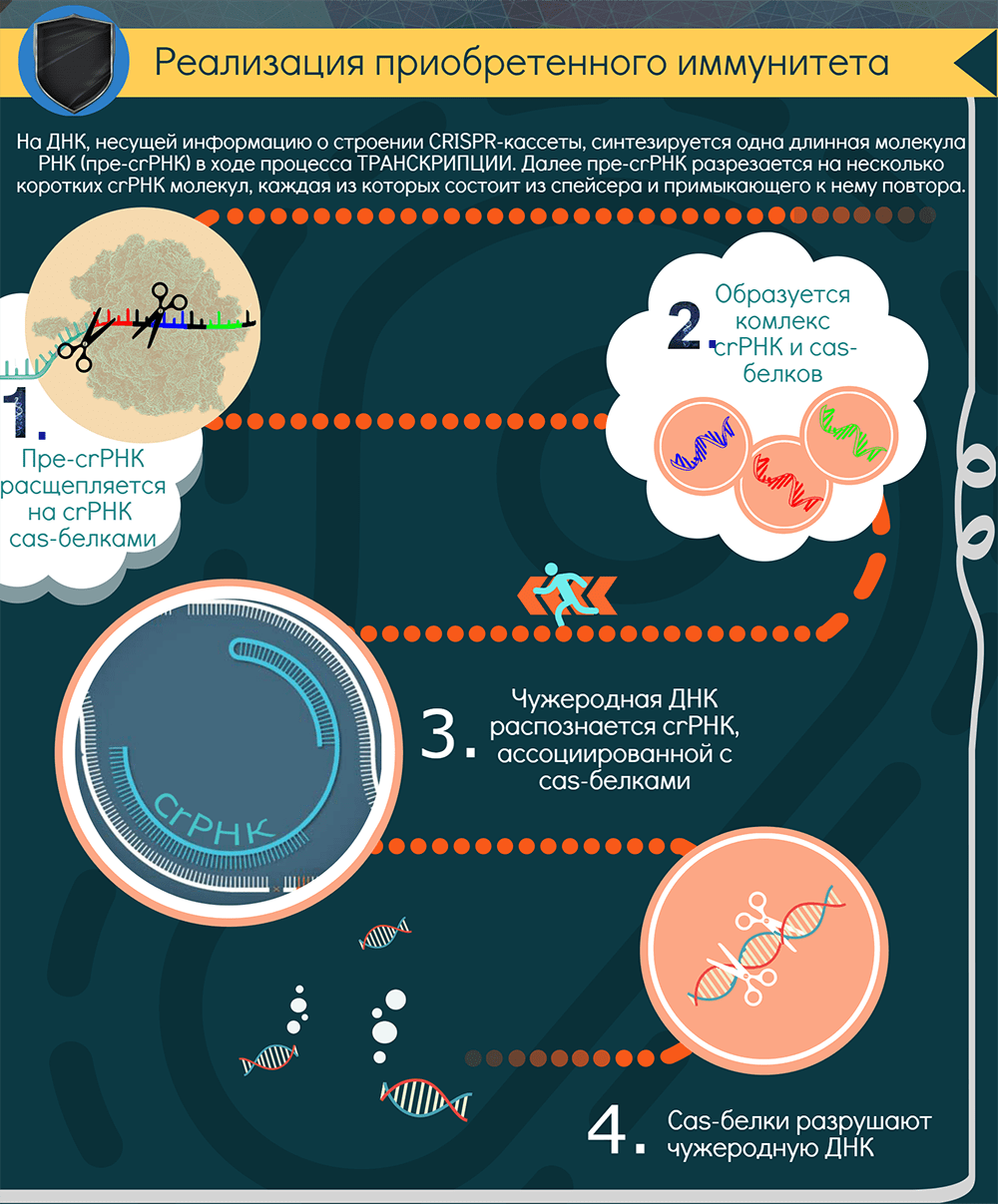
Для поиска повторно вторгающихся агентов CRISPR-кассета должна экспрессироваться. В результате ее транскрипции образуется длинная молекула РНК — pre-crРНК. С помощью РНКазы III и, как правило, Cas-белков транскрипт нарезается по повторам на отдельные crРНК — молекулы, содержащие один спейсер и кусочки окружающих его повторов (один из них длиннее). В системах II типа для этого процесса, называемого созреванием, необходим еще один участник — tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с cas-кластером [12].
Далее у систем I класса crРНК взаимодействует с комплексом Cas-белков, а у систем II класса crРНК либо дуплексы tracrРНК-crРНК связываются с одним белком-эффектором, например Cas9. Так образуется интерференционный функциональный модуль — рабочая иммунная единица, состоящая из направляющей РНК и эффекторного белка (или комплекса). Совокупность таких единиц «сканирует» клетку в поисках интервентов.
При обнаружении комплементарной crРНК последовательности, то есть протоспейсера, модуль «слипается» с ней и определяет, не помечена ли она как «своя», клеточная. Если нет, и если к ней прилегает тот самый PAM, эффекторный белок, который представляет собой эндонуклеазу, разрезает обе цепи ДНК в строго определенных местах. Весь процесс называется интерференцией. В особом случае, у системы VI типа, происходит РНК-интерференция, потому что эффекторный белок является рибонуклеазой и разрушает РНК. Так или иначе, атакованные фаги или плазмиды выводятся из строя. Ну и появляется лишняя возможность «наворовать» новые спейсеры.
Какие проблемы могут возникнуть при реализации иммунного ответа? Не исключено, что по мере удаления от лидерной последовательности, то есть от CRISPR-промотора, шансы спейсера транскрибироваться и созреть уменьшаются. Кроме того, есть мнение, что удаленные спейсеры со временем могут накапливать мутации, препятствующие эффективной интерференции с мишенью, или вовсе удаляться. Но раз адаптация новых спейсеров происходит вблизи промотора, удаленные спейсеры представляют собой фото агентов, давно не нападавших на эту клеточную линию, и в постоянной боеготовности по отношению к ним клетка не нуждается. Настоящей же проблемой могут стать даже однонуклеотидные мутации мишени. В общем, комплементарность в этом деле превыше всего.
А не приручить ли нам чужой иммунитет?

Детально изучив принципы работы стрептококковой системы CRISPR-Cas9 (II тип), ученые подумали: а почему бы не попробовать с ее помощью корректировать геномы других организмов? Появились новые надежды относительно лечения генетических (и не только) заболеваний человека, ведь этот способ редактирования in vivo мог оказаться эффективнее уже вовсю тестируемых в то время нуклеаз ZFN и TALEN [13].
Всё, что требовалось для новой технологии, — это разместить на векторах ген белка Cas9 и CRISPR-кассету, где спейсеры сделать идентичными местам генома, которые нужно изменить. Меняя число и тип спейсеров, можно модифицировать сразу несколько разных участков генома. Довольно быстро поняли, что tracrРНК и crРНК можно безболезненно объединить в одну химерную молекулу sgРНК (single-guide RNA), а РНКазу III в эукариотических клетках спокойно подменяют другие рибонуклеазы. Ну и еще потребовалось оптимизировать систему для эукариотических клеток: подправить кодонный состав и добавить ядерный «адрес», чтобы она четко следовала к месту работы — хромосомам.
Получилась простая и, что немаловажно, дешевая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре выбранного организма, CRISPR-транскрипт нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут цель. Когда sgРНК находит комплементарный участок в геноме организма, Cas9 разрезает «натупо» обе цепи ДНК. Всё, работа CRISPR-системы на этом окончена. Теперь эстафета передается репарационным системам самогό организма. Они решают, как лучше залатать разрез: то ли просто сшить куски (это будет негомологичное соединение концов, NHEJ), то ли, если есть подходящая матрица с флангами, комплементарными участкам ДНК с двух сторон от разрыва, поставить «заплатку» (это будет гомологичная рекомбинация). Так вот, первый вариант выгоден, если нужно что-то вырезать, второй — если нужно что-то вставить или заменить дефектный участок ДНК на нормальный, который просто вводят на подходящем векторе. Иногда используют гомологию с парной хромосомой, если на ней нужный локус не дефектный.
Разумеется, технология пока не лишена недостатков. Cas9, например, может проявлять нецелевую активность, «закрывая глаза» на мелкие несоответствия между sgРНК и мишенью. По словам К. Северинова, основная проблема — это биоинформатическое предсказание мишеней, поскольку, помимо наличия участка PAM, необходимо учитывать массу факторов, включая состояние хроматина. Кроме того, сценарий, по которому пойдет репарация разреза, не всегда соответствует желаемому, поэтому сейчас активно ищут факторы, влияющие на выбор этого сценария клеткой. Помимо оптимизации CRISPR-Cas9 и механизмов ее доставки в нужные клетки, ведется апробирование других типов CRISPR-систем [14].

Спектр применений CRISPR-Cas9 и ее модификаций.
Точки приложения CRISPR-технологии можно условно объединить в три крупные группы: «CRISPR — для исследований», «CRISPR — для биотехнологий» и «CRISPR — для терапии».
1. «CRISPR — для исследований». Технология позволяет изучать роль конкретных генов в процессах развития и жизнедеятельности организмов. Как вариант — устанавливать роль генов и их перестроек в возникновении и прогрессировании генетических болезней и рака: этот инструмент позволяет создавать прекрасные модельные системы [15].
Если Cas9 лишают одного нуклеазного домена, то белок становится никазой (nCas9) — режет только одну цепь ДНК, — а если лишают сразу двух, то белок становится инактивированным, или «мертвым» (dead, dCas9). Такой белок ничего не режет, зато систему CRISPR-dCas9 можно использовать для репрессии целых наборов генов или как платформу для конструирования более сложных регуляторных и модифицирующих комплексов. Например, если к ней привязать активирующий домен, то экспрессия целевых генов активируется. Для эпигенетической модификации нужных зон достаточно добавить модифицирующий домен. А пометив dCas9 флюоресцентными белками [16], можно визуализировать разные области хромосом. Ясно, что регуляторные возможности системы будут востребованы и в медицине. Кроме того, разные варианты CRISPR-Cas открывают новые возможности для скрининга мишеней лекарств [1].
2. «CRISPR — для биотехнологий». Здесь речь идет о применении CRISPR-Cas9 как минимум для трех целей:
для улучшения свойств сельскохозяйственных животных и растений. Уже создали и протестировали CRISPR-системы для риса, пшеницы, кукурузы, сорго и многих других культур. Детально эта кухня разобрана в обзоре [17]. Помимо улучшения пищевых качеств, такими инструментами легко наделять культуры устойчивостью к вредителям и химикалиям, а животных — избавлять от нежелательных генов. Например, недавно в свиных клетках инактивировали эндогенных ретровирусов (не то чтобы здоровья свиньи ради, а держа в голове планы по трансплантации ее органов человеку) [18];
для контроля распространения инфекций, переносимых животными. Например, уже всерьез размышляют о «заносе» в природные популяции малярийных комаров генов устойчивости к плазмодию или генов популяционного контроля [19]. Это стало принципиально возможным благодаря технологии «gene drive» (что-то типа «продвижения гена»), основанной на изменении классического наследования. С ее помощью встроенный в одну особь ген быстро распространяется по всей популяции. Принцип технологии иллюстрирует нашумевшая мутагенная цепная реакция у дрозофил [20];
для конструирования новых метаболических путей и осуществления направленной эволюции биомолекул. Новые или оптимизированные ферментные системы бактерий и грибов, получаемые так легко и дешево, — предел мечтаний технологов из целого ряда отраслей промышленности. Но даже простое встраивание в промышленно важные штаммы бактерий систем CRISPR-Cas с заданными свойствами может защитить их от бактериофагов и нежелательных плазмид.
3. «CRISPR — для терапии». Здесь пределов для фантазии, кажется, и вовсе нет. Если говорить о наследственных заболеваниях, то CRISPR-Cas9 в культурах клеток или животных моделях уже «примерили» для серповидноклеточной анемии и β-талассемии, M2DS-синдрома и миодистрофии Дюшенна, муковисцидоза (исправили мутантный CFTR-локус в кишечных стволовых клетках человека) и тирозинемии, катаракты (у мышей устранили доминантную мутацию в гене Crygc) и пигментного ретинита. Вообще, болезни глаз сейчас в центре внимания, потому что в глаза генетические конструкции легко доставлять [14].
Преимущества коррекции генома в зародышевой линии (как совокупности любых генеративных клеток, связывающих друг с другом поколения организмов) и стволовых клетках очевидны, но даже изменения, вносимые в соматические клетки уже развитых органов, дают эффект. Особенно если речь идет о борьбе с болезнями печени и мышц. О результатах терапевтического применения CRISPR-Cas9 в разных типах клеток рассказывает свежий обзор [21].
Отдельное перспективное направление — борьба с хроническими вирусными заболеваниями типа гепатитов и ВИЧ-инфекции. Если возбудитель сохраняется в организме в виде провируса (вирусной ДНК, встроенной в клеточный геном), то его можно просто вырезать. Именно так и поступил коллектив биологов из США, избавив лимфоциты человека от ВИЧ (об этом сообщили сразу две «биомолекулярные» статьи: «Битва века: CRISPR VS ВИЧ» [22] и «CRISPR/Cas9 как помощник в борьбе с ВИЧ» [23]). Правда, ВИЧ — объект крайне изменчивый, и с ним еще придется поломать копья.
Можно помечтать, что в терапии опухолей найдут применение варианты недавно описанной CRISPR-системы VI типа — той, что уничтожает только РНК, причем, как оказалось, любую клеточную РНК без разбора: запустить такую систему в раковую клетку — это как наслать на нее проклятье [14].
CRISPR-Cas — это не только иммунитет.
Оказывается, для бактерий и их эволюции эта система значит намного больше.
Неканонические активности CRISPR-систем или их отдельных компонентов возникали как побочные продукты их иммунной функции либо как самостоятельно отбираемые признаки. Скорее всего, CRISPR-кассеты и Cas-белки когда-то работали порознь, причем исходная задача последних состояла в регуляции экспрессии генов и репарации ДНК [7]. Современные компоненты CRISPR-Cas замечены:
в регуляции активности генов. Эти системы могут вмешиваться в общение бактерий по типу quorum sensing («чувство кворума») [24] и регулировать таким образом групповое поведение: формирование плодовых тел и спор у миксококков и биопленок у синегнойной палочки. Белки Cas9 (систем II типа) регулируют вирулентность патогенов Legionella pneumophila, Francisella novicida, Campylobacter jejuni и, возможно, Neisseria meningitidis;
в репарации ДНК. Cпособность к разрезанию CRISPR-кассеты для встраивания новых спейсеров, скорее всего, вторичное функциональное приобретение Cas1. Исходно он резал типичные рекомбинационные/репарационные интермедиаты и пока что не разучился это делать. Поэтому экспрессия генов cas повышает устойчивость некоторых бактерий к радиации, а отключение CRISPR-системы ведет к повышению их чувствительности к повреждающим ДНК факторам и нарушению расхождения хромосом;
в ремоделировании (реорганизации) генома. Cas-белки иногда ошибаются и вместо вражеской ДНК делают спейсерами фрагменты своего генома. Если последовавшие за этим «аутоиммунные» реакции не приводят к гибели клетки, то чаще всего происходят крупные перестройки, направленные на частичное или полное избавление от «проштрафившейся» CRISPR-системы. Иногда перестройки могут повысить приспособленность хозяина к нише — например, за счет дупликации полезных генов;
в конкуренции мобильных генетических элементов друг с другом, если они несут эти самые CRISPR-Cas-системы;
во введении бактерий в «спящее», неактивное состояние. Функция эта по сути тоже иммунная, но экстремальная. Предполагают, что в избранных CRISPR-системах один из Cas-белков может служить «токсином», а его партнер — «антитоксином», и когда в клетку проникает фаг, «токсин» высвобождается и начинает крушить любую РНК. Но у «замирающей» при этом клетки есть время лихорадочно насобирать спейсеры. Если это не получается, то разбушевавшийся Cas-токсин доводит клетку до самоубийства. Доказать этот принцип пока не удалось [7]. Зато подобный драматический финал мы уже где-то видели: именно так поступает система VI типа. Такой исход фаговой инвазии называется абортивной инфекцией. Для клетки плохо, для популяции — хорошо.

Источник: Biomolecula
Как работает CRISPR-Cas9. Мульт теория.
Технология редактирования генома CRISPR/Cas9
Генная инженерия изменит всё и навсегда – CRISPR
Наука за минуту. Технология CRISPR-CAS9
Как исправить ДНК человека
Дополнительно:
Три новости о генетически модифицированных организмах.
























Оценили 9 человек
13 кармы